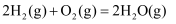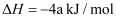热化学方程式 知识点题库
-
(1) 火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水.当把0.4mol液态肼和0.8mol H2O2混合反应,生成氮气和水蒸气,放出257.7kJ的热量(相当于25℃、101kPa下测得的热量).
①反应的热化学方程式为.
②又已知H2O(l)=H2O(g)△H=+44kJ/mol.则16g液态肼与液态双氧水反应生成液态水时放出的热量是kJ.
③此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是.
-
(2) 盖斯定律在生产和科学研究中有很重要的意义.有些反应的反应热虽然无法直接测得,但可通过间接的方法测定.现根据下列3个热化学反应方程式:
Fe2O3(s)+3CO(g)═2Fe(s)+3CO2(g),△H=﹣24.8kJ/mol;
3Fe2O3(s)+CO(g)═2Fe3O4(s)+CO2(g),△H=﹣47.4kJ/mol;
Fe3O4(s)+CO(g)═3FeO(s)+CO2(g),△H=+640.5kJ/mol.
写出CO气体还原FeO固体得到Fe 固体和CO2气体的热化学反应方程式: .
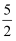 O2(g)═2CO2(g)+H2O(l);△H=2b kJ/mol
C . 2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l);△H=2b kJ/mol
D . 2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l);△H=b kJ/mol
O2(g)═2CO2(g)+H2O(l);△H=2b kJ/mol
C . 2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l);△H=2b kJ/mol
D . 2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l);△H=b kJ/mol
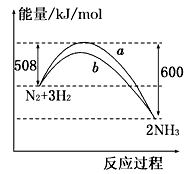
 2NH3 , △H = -92kJ·mol-1
B . 在温度体积一定的条件下, 通入1mol N2和3molH2反应后放出的热量为92kJ
C . b曲线是加入催化剂时的能量变化曲线
D . 加入催化剂, 该化学反应的ΔH不改变
2NH3 , △H = -92kJ·mol-1
B . 在温度体积一定的条件下, 通入1mol N2和3molH2反应后放出的热量为92kJ
C . b曲线是加入催化剂时的能量变化曲线
D . 加入催化剂, 该化学反应的ΔH不改变
-
(1) 工业上提纯镓的方法很多,其中以电解精炼法为多。具体原理如下:以待提纯的粗镓(内含Zn、Fe、Cu杂质)为阳极,以高纯镓为阴极,以NaOH水溶液为电解质溶液。在电流作用下使粗镓在阳极溶解进入电解质溶液,并通过某种离子迁移技术到达阴极并在阴极放电析出高纯镓。
①已知离子氧化性顺序为Zn2+<Ga3+<Fe2+<Cu2+。电解精炼镓时阳极泥的成分是。
②GaO2-在阴极放电的电极方程式是。
-
(2) 工业上利用固态Ga与NH3高温条件下合成固体半导体材料氮化镓(GaN)同时又有氢气生成。反应中每生成3 mol H2时就会放出30.8 kJ热量。
①该反应的热化学方程式为。
②一定条件下,加入一定量的Ga与NH3进行上述反应,下列叙述符合事实且可作为判断反应已达到平衡状态的标志的是。
A.恒温恒压下,混合气体的密度不变
B.断裂3 mol H-H键,同时断裂2 mol N-H键
C.恒温恒压下达平衡后再加入2 mol H2使平衡移动,NH3消耗速率等于原平衡时NH3的消耗速率
D.升高温度,氢气的生成速率先增大再减小
-
(1) I.NO是一种常见化合物,对其进行研究具有重要的价值和意义。
2NO(g)+O2(g)=2NO2(g) △H=akJ/mol的反应历程与能量变化关系如图所示。

①a0(填>或<)
②已知:第Ⅱ步反应为:NO3(g)+NO(g)=2NO2(g) △H=bkJ/mol
第I步反应的热化学方程式为。
-
(2) 汽车尾气中常含有NO。NH3在加热和催化剂存在的条件下能消除NO的污染。
已知:4NH3(g)+5O2(g)=4NO(g)+6H2O(g) △H=-905kJ/mol
4NH3(g)+3O2(g)=2N2(g)+6H2O(g) △H=-1268kJ/mol
NH3与NO反应的热化学方程式为。
-
(3) 工业上NO的重要来源是NH3 , NH3也可作为燃料设计成碱性燃料电池,在碱性条件下,燃料电池产物主要为N2。燃料电池负极的电极反应式为。氨气作为燃料的电池和含碳化合物作为燃料的电池相比,主要的优点是。
-
(4) II.含乙酸钠和对氯酚
 的废水可通过如下装置处理,其原理如图所示:
的废水可通过如下装置处理,其原理如图所示: 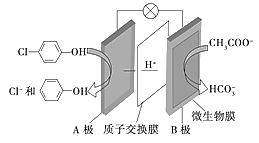
写出HCO3-的电子式。乙酸钠中含有的化学键类型有。
-
(5) 电池的正极是,溶液中H+的移动方向是(填A→B或B→A)
-
(6) B极发生的电极反应方程式为。
2H2S(g)+3O2(g)=2SO2(g)+2H2O(l) △H=Q1 kJ/mol
2H2S(g)+O2(g)=2S (s)+2H2O(l) △H=Q2 kJ/mol
2H2S(g)+O2(g)=2S (s)+2H2O(g) △H=Q3 kJ/mol
判断Q1、Q2、Q3三者关系正确的是( )

-
(1) 写出该反应的化学方程式;
-
(2) 0~4分钟时,A的平均反应速率为;
-
(3) 到达平衡时B的转化率为;
-
(4) 已知:
t/℃
700
800
830
1000
1200
K
2.6
1.7
1.0
0.9
0.6
该反应正向是热反应;
-
(5) 红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g),反应过程和能量关系如图所示(图中的ΔH表示生成1mol产物的数据)。

根据上图可知:P和Cl2反应生成PCl5的热化学方程式是。
-
(6) 1mol气态钠离子和1mol气态氯离子结合生成1mol氯化钠晶体释放出的热能为氯化钠晶体的晶格能。
①下列热化学方程式中,能直接表示出氯化钠晶体晶格能的是。
A.Na+(g)+Cl-(g)→NaCl(s) △Q1 B.Na(s)+
 Cl2(g)→NaCl(s) △Q2
Cl2(g)→NaCl(s) △Q2C.Na(s)→Na(g) △Q3 D.Na(g)-e-→Na+(g) △Q4
E.
 Cl2(g)→Cl(g) △Q5 F.Cl-(g)-e-→Cl(g) △Q6
Cl2(g)→Cl(g) △Q5 F.Cl-(g)-e-→Cl(g) △Q6②写出△Q2与△Q1、△Q3、△Q4、△Q5、△Q6之间的关系式。
 HNC(g)异构化反应过程的能量变化如图所示。下列说法正确的是 ( )
HNC(g)异构化反应过程的能量变化如图所示。下列说法正确的是 ( ) 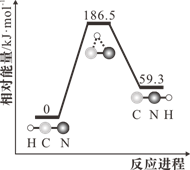
 HNC(g)+59.3kJ
HNC(g)+59.3kJ
-
(1) 在催化剂作用下 CO还原 NO、NO2。
标准摩尔生成焓是指由稳态单质生成1mol该化合物的焓变,25℃下几种物质的标准生成焓如下:
NO2
CO
CO2
NO
标准生成焓/kJ•mol-1
33.1
-110.5
-183.6
90.3
ⅰ.CO(g)+NO2(g)
 CO2(g(+NO(g) ΔH1
CO2(g(+NO(g) ΔH1ⅱ.2CO(g)+2NO(g)
 2CO2(g)+N2(g) ΔH2=-623KJ• mol-1
2CO2(g)+N2(g) ΔH2=-623KJ• mol-1①ΔH1=;写出用 CO还原NO2生成两种无污染的气态物质总反应的热化学方程式:
②相同时间内,CO还原NO2的总反应中NO2的转化率随温度的变化趋势如下图所示,运用化学反应原理分析,NO2的转化率随温度先增大后减小的原因;其中汽车尾气中NO2和 CO物质的量比
 为(填选项字母)时尾气中NO2的转化率最高。
为(填选项字母)时尾气中NO2的转化率最高。A.0.3 B.0.5 C.0.7

③某温度下,起始压强为 P0 , 在恒容密闭容器中充入等物质的量 CO和 NO在催化剂下进行反应ⅱ,NO的平衡转化率为α , 则反应ⅱ的平衡常数 KP=(用平衡分压代替平衡浓度计算,分压 =总压 × 物质的量分数)。
-
(2) 在催化剂作用下 H2还原 NO,2H2(g)+2NO(g)
 2H2O(g)+N2(g)ΔH<0,反应的速率方程为v正 =k正• c(H2)• c2(NO)(k正为速率常数,只与温度、催化剂有关系),其中 v正为正反应速率。
2H2O(g)+N2(g)ΔH<0,反应的速率方程为v正 =k正• c(H2)• c2(NO)(k正为速率常数,只与温度、催化剂有关系),其中 v正为正反应速率。 ①相同条件下,对速率影响程度c(NO)c(H2)(填“ 大于” 、“ 小于” 或“ 等于” )。
②设反应开始时 H2和 NO的浓度相同,反应开始时 v正 =v0 , NO的转化率为α时的反应速率为 vα , 则vα =v0。
-
(3) 一种以 CO为燃料,以空气为氧化剂,以熔融态 K2CO3为电解质的燃料电池,工作原理如下图所示:
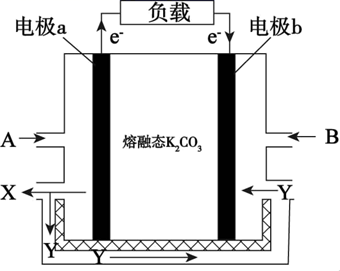
①电极 a为(填“ 正极” 或“ 负极” ),Y物质为;
②正极上的电极反应式为。
 ,
,  ,
,  等气体的无害化处理对治理大气污染、建设生态文明具有重要意义。
等气体的无害化处理对治理大气污染、建设生态文明具有重要意义。已知,① , 反应体系中每摩尔气态物质分解为气态基态原子消耗的能量如下表所示:
, 反应体系中每摩尔气态物质分解为气态基态原子消耗的能量如下表所示:
| CO |
| NO |
812 kJ | 1076 kJ | 1490 kJ | 632 kJ |
②

③

-
(1) 试写出NO与CO反应生成无污染物气体的热化学方程式。
-
(2) 将
 与
与 按体积比1∶1充入恒容密闭容器中发生反应:
按体积比1∶1充入恒容密闭容器中发生反应:

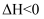
①保持恒温,下列能说明反应达到平衡状态的是(填标号)。
a.体系压强保持不变 b.混合气体密度保持不变
c.
 和NO的体积比保持不变 d.每消耗
和NO的体积比保持不变 d.每消耗 的同时生成
的同时生成
②
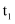 ℃、
℃、 ℃时,物质的分压变化如图所示。根据题意可知:
℃时,物质的分压变化如图所示。根据题意可知: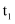
 (填“>”“<”或“=”),由平衡状态a到b,改变的条件是。
(填“>”“<”或“=”),由平衡状态a到b,改变的条件是。
-
(3)
 与CO在一定条件下的反应为:
与CO在一定条件下的反应为: , 某温度下,在1 L密闭容器中充入
, 某温度下,在1 L密闭容器中充入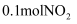 和
和 , 此时容器的压强为p,5秒时反应达到平衡,容器的压强减小
, 此时容器的压强为p,5秒时反应达到平衡,容器的压强减小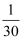 。回答下列问题:
。回答下列问题:①反应开始到平衡时CO的平均反应速率

 ;
; (用含p的代数式表示,已知:某气体的分压=总压×该气体的物质的量分数)
(用含p的代数式表示,已知:某气体的分压=总压×该气体的物质的量分数)②若此温度下,某时刻测得
 、
、 、
、 、
、 的浓度分别为
的浓度分别为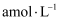 、
、 、
、 、
、 , 要使反应向逆反应方向进行,a的取值范围是。
, 要使反应向逆反应方向进行,a的取值范围是。
 燃烧生成液态水放出
燃烧生成液态水放出 的热量,则下列热化学方程式书写正确的是( )
的热量,则下列热化学方程式书写正确的是( )

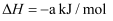 B .
B . 
 C .
C . 
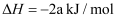 D .
D .