溶液的组成及性质 知识点
溶液的组成及性质 知识点题库
下图是a、b两种固体物质的溶解度曲线。下列说法不正确的是( )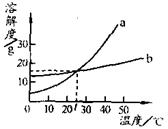
20℃时,将等质量的甲、乙两种固体物质,分别加入到盛有100g水的烧杯中,充分搅拌后现象如图1,加热到50℃时,现象如图2,甲、乙两种物质的溶解度曲线如图3,请结合图示回答下列问题: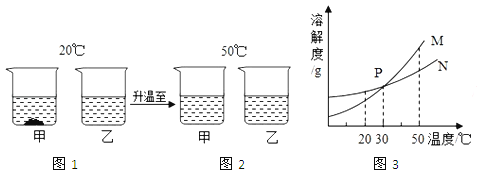
-
(1) 图1中一定为饱和溶液的是
-
(2) 图2中甲乙两溶液中溶质质量分数的大小关系为
-
(3) 图3中表示乙的溶解度曲线是 P点表示的含义是
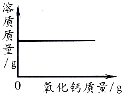 向一定量的饱和石灰水中加入氧化钙
B .
向一定量的饱和石灰水中加入氧化钙
B . 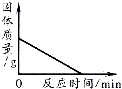 加热一定量高锰酸钾固体产生氧气
C .
加热一定量高锰酸钾固体产生氧气
C . 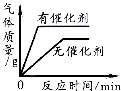 用一定量的双氧水制取氧气
D .
用一定量的双氧水制取氧气
D . 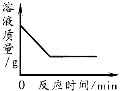 向一定量的硝酸银溶液中插入铜丝
向一定量的硝酸银溶液中插入铜丝
| 实验序号 | 水的质量/g | 加入NaCl的质量/g | 未溶的NaCl的质量/g |
| ① | 10 | 2 | 0 |
| ② | 10 | 3 | 0 |
| ③ | 10 | 4 | 0.4 |
下列叙述正确的是( )
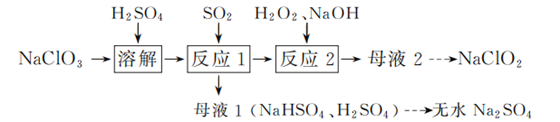
已知:① 2ClO2+H2O2+2NaOH=2NaClO2+O2+2H2O;
② 2ClO2+2NaOH=NaClO2+NaClO3+H2O;
③温度高于60 ℃时,NaClO2发生分解生成NaClO3和NaCl。
-
(1) 反应1中SO2与NaClO3反应制得ClO2气体,该反应的化学方程式为。
-
(2) 在图1所示装置中发生反应2生成NaClO2 , 反应过程中放出大量的热。
①研究表明,实验时吸收液中H2O2与NaOH的物料比需要控制在0.8左右,原因可能是。
②在吸收液中H2O2和NaOH的物料比、浓度和体积不变的条件下,控制反应在0~3 ℃进行,实验中可采取的措施是。
③装置Ⅱ的作用是。
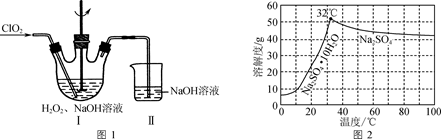
-
(3) 母液2经过减压蒸发、冷却结晶等操作获得NaClO2粗产品。实验中采用减压蒸发的原因是。
-
(4) Na2SO4的溶解度曲线如图2所示。请补充完整由母液1制备无水Na2SO4的实验方案:,用无水乙醇洗涤,干燥得到产品。
-
(1) Ⅰ.下表为侯氏制碱法中部分物质的溶解度。
温度/℃
10
20
30
40
溶解度/g
Na2CO3
12.2
21.8
39.7
48.8
NaCl
35.8
36.0
36.3
36.6
NaHCO3
8.2
9.6
11.1
12.7
由上表可知,氯化钠和碳酸钠溶解度可能相等的温度范围是℃。
-
(2) 制碱原理为向饱和的NaCl溶液中通入足量NH3和CO2生成NaHCO3晶体和NH4Cl,过滤出NaHCO3加热分解即制得纯碱。
①生成NaHCO3的化学方程式为。
②结合上表分析,析出NaHCO3晶体的原因可能有(填序号)。
A.溶剂质量减少
B.同温下NaHCO3溶解度小于NaCl
C.生成的NaHCO3不稳定,受热易分解
-
(3) Ⅱ.某兴趣小组同学制定如下方案对含有NaCl杂质的纯碱的含量进行测定:用如图装置测定样品与足量稀硫酸反应生成CO2的体积(已知:常温常压下CO2气体的密度为ρg/L)。
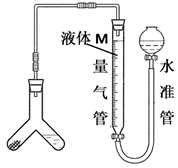
为了减小实验误差,量气管中液体M的选择原则是。若实验测得样品纯碱含量低于样品实际含量,可能的原因是。
a.CO2气体中含有水蒸气
b.测定气体体积时未冷却至室温
c.Y型管中留有反应生成的气体
d.测定气体体积时水准管的液面高于量气管的液面
-
(4) 上述实验过程需要用到90mL 1.00mol/L的H2SO4溶液,实验室只有质量分数为98% ρ=1.84g/mL的浓硫酸。
①配制该稀硫酸时需要用到的玻璃仪器有:烧杯、玻璃棒、量筒、、。
②经计算需用量筒量取mL的浓硫酸。
③下列操作会使配制的稀硫酸浓度偏高的是。
A.用量筒量取浓硫酸时,将量筒壁上残留的少量浓硫酸用水洗涤,并将洗涤液也转移至容量瓶中
B.硫酸加水稀释后未冷却就转移定容
C.定容时加水超过刻度线,立即用胶头滴管将过量的水吸出
D.定容摇匀后发现液面低于刻度线,再加水补足



