电解质在水溶液中的电离 知识点题库
下列物质在水中最易电离出氢离子的是( )
A . C2H5OH
B . C6H5OH
C . H2O
D . CH3COOH
常温下,向100mL0.1mol/LNH4Cl溶液中,逐滴滴加0.1mol/L NaOH溶液。NH4+和NH3·H2O的变化趋势如图所示(不考虑NH3的逸出)。下列说法正确的是( )

A . M点溶液中水的电离程度比原溶液大
B . 在M点时,n(H+)-n(OH-)=(0.005-a)mol
C . 随着NaOH溶液的滴加,  不断增大
D . 当n(NaOH)=0.01mol时,c(NH3·H2O)>c(Na+)>c(OH-)
不断增大
D . 当n(NaOH)=0.01mol时,c(NH3·H2O)>c(Na+)>c(OH-)
 不断增大
D . 当n(NaOH)=0.01mol时,c(NH3·H2O)>c(Na+)>c(OH-)
不断增大
D . 当n(NaOH)=0.01mol时,c(NH3·H2O)>c(Na+)>c(OH-)
下列物质的水溶液呈碱性的是( )
A . CH3COOH
B . CH3COONa
C . CH3CH2OH
D . NH4Cl
25℃时,将浓度均为0.1mol·L-1、体积分别为Va和Vb的HA溶液与BOH溶液按不同体积比混合,保持Va+Vb=100 mL,Va、Vb与混合液pH的关系如图所示。下列说法错误的是()

A . HA为弱酸,BOH为弱碱
B . b点时,c(B+)=c(A-)
C . c点时,混合溶液呈碱性的主要原因是过量的BOH电离出OH- , 使得溶液中c(OH-)>c(H+)
D . a→c过程中水的电离程度始终增大
NaOH溶液滴定邻苯二甲酸氢钾(邻苯二甲酸氢钾H2A的Ka1=1.1×10−3 , Ka2=3.9×10−6)溶液,混合溶液的相对导电能力变化曲线如图所示,其中b点为反应终点。下列叙述错误的是( )

A . 混合溶液的导电能力与离子浓度和种类有关
B . Na+与A2−的导电能力之和大于HA−的
C . b点的混合溶液pH=7
D . c点的混合溶液中,c(Na+)>c(K+)>c(OH−)
下列叙述正确的是( )
A . 氯气的水溶液能导电,所以氯气属于电解质
B . 强电解质水溶液的导电性不一定比弱电解质强
C . 硫酸铜晶体含有一定量的结晶水,所以硫酸铜晶体能导电
D . 在任何条件下,电解质的电离都能完全彻底
下列溶液中,跟 100 mL 0.5 mol•L-1 NaCl 溶液中所含的 Cl-物质的量浓度相同的是( )
A . 100 mL 0.5 mol•L-1 MgCl2溶液
B . 200 mL 0.25 mol•L-1 AlCl3溶液
C . 50 mL 1 mol•L-1 NaCl 溶液
D . 25 mL 0.5 mol•L-1 HCl 溶液
已知:BF3和水反应生成氟硼酸(HBF4)和硼酸(H3BO3),一定条件下BF3与一定量水可形成  晶体Q(
晶体Q(  )。下列有关说法,正确的是( )
)。下列有关说法,正确的是( )
 晶体Q(
晶体Q(  )。下列有关说法,正确的是( )
)。下列有关说法,正确的是( )
A . BF3和水反应生成氟硼酸和硼酸是氧化还原反应
B . BF3分子中,每个原子的最外层都具有8电子稳定结构
C . 晶体Q中存在离子键、共价键、范德华力和氢键
D . H3BO3在水中只发生反应:  ,可知硼酸是一元酸
,可知硼酸是一元酸
 ,可知硼酸是一元酸
,可知硼酸是一元酸
下列事实能说明H2SO3不是强电解质的是( )
①0.05mol/LH2SO3溶液的c(H+)=10-3mol/L
②相同条件下,H2SO3的导电能力比H2SO4弱
③H2SO3不稳定,易分解
④H2SO3能与碳酸钠反应制CO2
⑤H2SO3能和水以任意比例互溶
⑥1molH2SO3能够消耗2molNaOH
A . ①②⑤
B . ①②④
C . ①②③⑤
D . ①②
25℃,向20 mL 0.1 mol·L-1 H2A溶液中滴加0.1 mol·L-1的NaOH溶液,有关粒子物质的量的变化如图所示。下列说法正确的是( )

A . II表示微粒A2-的物质的量的变化曲线
B . H2A在水中的第一步电离方程式为H2A  A2-+2H+
C .
A2-+2H+
C .  的值随着V[NaOH(aq)]的增大而减小
D . V[NaOH(aq)]=20 mL时,溶液中存在关系:c(HA-)+c(A2-)+c(H2A)=0.1 mol/L
的值随着V[NaOH(aq)]的增大而减小
D . V[NaOH(aq)]=20 mL时,溶液中存在关系:c(HA-)+c(A2-)+c(H2A)=0.1 mol/L
 A2-+2H+
C .
A2-+2H+
C .  的值随着V[NaOH(aq)]的增大而减小
D . V[NaOH(aq)]=20 mL时,溶液中存在关系:c(HA-)+c(A2-)+c(H2A)=0.1 mol/L
的值随着V[NaOH(aq)]的增大而减小
D . V[NaOH(aq)]=20 mL时,溶液中存在关系:c(HA-)+c(A2-)+c(H2A)=0.1 mol/L
室温下H2SO4是二元强酸,其稀溶液中,第一步解离是完全的,第二步解离程度较低,HSO 
 H++SO
H++SO  (K2=1.0×10-2)。设NA为阿伏加德罗常数的值,下列说法正确的是( )
(K2=1.0×10-2)。设NA为阿伏加德罗常数的值,下列说法正确的是( )

 H++SO
H++SO  (K2=1.0×10-2)。设NA为阿伏加德罗常数的值,下列说法正确的是( )
(K2=1.0×10-2)。设NA为阿伏加德罗常数的值,下列说法正确的是( )
A . 56 g单质铁与足量稀硫酸反应产生22.4 L H2
B . 1 L 0.1 mol/L的硫酸溶液中,含H+的数目为0.2 NA
C . 室温下,NaHSO4溶液显碱性
D . 稀硫酸溶液中存在关系:c(HSO  )+c(OH-)+2c(SO
)+c(OH-)+2c(SO  )=c(H+)
)=c(H+)
 )+c(OH-)+2c(SO
)+c(OH-)+2c(SO  )=c(H+)
)=c(H+)
下列电离方程式正确的是( )
A . Ba(OH)2 =Ba2+ +OH  B . K2SO4 =2K+ +SO
B . K2SO4 =2K+ +SO  C . NaOH=Na+ +OH-
D . KMnO4=K++Mn7++4O2-
C . NaOH=Na+ +OH-
D . KMnO4=K++Mn7++4O2-
 B . K2SO4 =2K+ +SO
B . K2SO4 =2K+ +SO  C . NaOH=Na+ +OH-
D . KMnO4=K++Mn7++4O2-
C . NaOH=Na+ +OH-
D . KMnO4=K++Mn7++4O2-
NaHSO4在水溶液中能够电离出H+、Na+、和SO 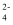 。下列对于NaHSO4的分类中错误的是( )
。下列对于NaHSO4的分类中错误的是( )
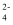 。下列对于NaHSO4的分类中错误的是( )
。下列对于NaHSO4的分类中错误的是( )
A . NaHSO4是盐
B . NaHSO4是酸式盐
C . NaHSO4是钠盐
D . NaHSO4是酸
下列叙述错误的是( )
A . 向0.1 mol·L-1的氨水中加入少量硫酸铵固体,则溶液中  减小
B . 两种醋酸溶液的物质的量浓度分别为c1和c2 , pH分别为a和a+1,则c1>10c2
C . pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,滴入石蕊溶液呈红色
D . 将稀氨水逐滴加入稀硫酸中,当溶液的pH=7时,c(SO
减小
B . 两种醋酸溶液的物质的量浓度分别为c1和c2 , pH分别为a和a+1,则c1>10c2
C . pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,滴入石蕊溶液呈红色
D . 将稀氨水逐滴加入稀硫酸中,当溶液的pH=7时,c(SO  ) = 2c(NH
) = 2c(NH  )
)
 减小
B . 两种醋酸溶液的物质的量浓度分别为c1和c2 , pH分别为a和a+1,则c1>10c2
C . pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,滴入石蕊溶液呈红色
D . 将稀氨水逐滴加入稀硫酸中,当溶液的pH=7时,c(SO
减小
B . 两种醋酸溶液的物质的量浓度分别为c1和c2 , pH分别为a和a+1,则c1>10c2
C . pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,滴入石蕊溶液呈红色
D . 将稀氨水逐滴加入稀硫酸中,当溶液的pH=7时,c(SO  ) = 2c(NH
) = 2c(NH  )
)
对于数以千万计的化学物质和为数众多的化学反应,分类法的作用几乎是无可代替的。
-
(1) Ⅰ、现有下列物质:①
 晶体 ②熔融
晶体 ②熔融  ③石墨 ④稀硫酸 ⑤
③石墨 ④稀硫酸 ⑤  溶液⑥液态氯化氢 ⑦酒精 ⑧氨水 ⑨
溶液⑥液态氯化氢 ⑦酒精 ⑧氨水 ⑨  ⑩澄清石灰水。回答下列问题:
⑩澄清石灰水。回答下列问题: 上述状态下可导电的是(填序号),属于电解质的是(填序号)。
-
(2) 写出
 、
、  在水溶液中的电离方程式。
在水溶液中的电离方程式。
-
(3) ⑤与少量的⑩的离子反应方程式是
-
(4) Ⅱ、某同学称取一定量的固体配成溶液,在该溶液中先加入一定量的稀盐酸,然后逐滴加入
 溶液(如图甲所示)滴加过程中生成沉淀的质量与加入
溶液(如图甲所示)滴加过程中生成沉淀的质量与加入  溶液的体积的关系如图乙所示。请回答下列问题:
溶液的体积的关系如图乙所示。请回答下列问题: 
溶解
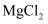 固体所用的玻璃仪器有(填字母)。
固体所用的玻璃仪器有(填字母)。a、托盘天平 b、烧杯 c、漏斗 d、玻璃棒
-
(5)
 段发生反应的离子方程式为;
段发生反应的离子方程式为;
-
(6) 在
 点对应的溶液中滴加
点对应的溶液中滴加  溶液,观察到的现象是,发生反应的离子方程式为。
溶液,观察到的现象是,发生反应的离子方程式为。
设 为阿伏加德罗常数的值,下列说法正确的是( )
为阿伏加德罗常数的值,下列说法正确的是( )
 为阿伏加德罗常数的值,下列说法正确的是( )
为阿伏加德罗常数的值,下列说法正确的是( )
A . 室温下,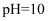 的
的 溶液中由水电离出的
溶液中由水电离出的 数目为
数目为 B . 将
B . 将 溶于稀氨水中,所得溶液呈中性,则溶液中
溶于稀氨水中,所得溶液呈中性,则溶液中 的数目为
的数目为 C .
C .  中所含共用电子对数目为
中所含共用电子对数目为 D . 将
D . 将 氯气通入足量水中充分反应后,
氯气通入足量水中充分反应后, 、
、 、
、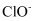 的微粒数之和为
的微粒数之和为
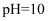 的
的 溶液中由水电离出的
溶液中由水电离出的 数目为
数目为 B . 将
B . 将 溶于稀氨水中,所得溶液呈中性,则溶液中
溶于稀氨水中,所得溶液呈中性,则溶液中 的数目为
的数目为 C .
C .  中所含共用电子对数目为
中所含共用电子对数目为 D . 将
D . 将 氯气通入足量水中充分反应后,
氯气通入足量水中充分反应后, 、
、 、
、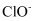 的微粒数之和为
的微粒数之和为
下列示意图与化学用语表述内容不相符的是(水合离子用相应离子符号表示)( )
A | B | C | D |
NaCl溶于水 |
电解CuCl2溶液 |
CH3COOH在水中电离 | H2与Cl2反应能量变化 |
NaCl=Na++Cl− | CuCl2=Cu2++2Cl− | CH3COOH | H2(g)+Cl2(g)=2HCl(g) ΔH=−183kJ·mol−1 |
A . A
B . B
C . C
D . D
下列叙述正确的是( )
A . Cl2的水溶液可以导电,所以Cl2属于电解质
B . NaCl属于电解质,所以固体NaCl能导电
C . 液态氯化氢不导电,但其属于电解质
D . KNO3溶液在电流的作用下电离成K+和NO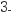
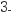
常温时,向 溶液中逐滴加入
溶液中逐滴加入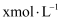 的氨水,导电能力、pH与
的氨水,导电能力、pH与 的关系变化如图所示(假设反应过程中温度不变)。下列分析错误的是( )
的关系变化如图所示(假设反应过程中温度不变)。下列分析错误的是( )
 溶液中逐滴加入
溶液中逐滴加入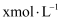 的氨水,导电能力、pH与
的氨水,导电能力、pH与 的关系变化如图所示(假设反应过程中温度不变)。下列分析错误的是( )
的关系变化如图所示(假设反应过程中温度不变)。下列分析错误的是( )
A . 水的电离程度: B .
B .  , 该温度下的
, 该温度下的 C . 该温度下反应
C . 该温度下反应 的平衡常数的数量级为
的平衡常数的数量级为 D . a点对应的溶液中存在
D . a点对应的溶液中存在
 B .
B .  , 该温度下的
, 该温度下的 C . 该温度下反应
C . 该温度下反应 的平衡常数的数量级为
的平衡常数的数量级为 D . a点对应的溶液中存在
D . a点对应的溶液中存在
在常温下,有关下列4种溶液的叙述中错误的是( )
编号 | ① | ② | ③ | ④ |
溶液 | 氨水 | 氢氧化钠溶液 | 醋酸 | 盐酸 |
pH | 11 | 11 | 3 | 3 |
A . 分别取1mL稀释至10mL,四种溶液的pH:①>②>③>④
B . 在溶液①、②中分别加入适量的氯化铵晶体,两种溶液的pH均减小
C . 将aL溶液④与bL溶液②混合后,若所得溶液的pH=4,则a:b=11:9
D . 将溶液①、④等体积混合,所得溶液中:c(NH )>c(Cl-)>c(OH-)>c(H+)
)>c(Cl-)>c(OH-)>c(H+)
 )>c(Cl-)>c(OH-)>c(H+)
)>c(Cl-)>c(OH-)>c(H+)
最近更新




 CH3COO−+H+
CH3COO−+H+


