电解质在水溶液中的电离 知识点题库
已知单位体积的稀溶液中,非挥发性溶质的分子或离子数越多,该溶液的沸点就越高.则下列溶液沸点最高的是( )
A . 0.01 mol•L﹣1的蔗糖溶液
B . 0.01 mol•L﹣1的CaCl2溶液
C . 0.01 mol•L﹣1的NaCl溶液
D . 0.02 mol•L﹣1的CH3COOH溶液
已知在常温下测得浓度均为0.1mol/L的下列6种溶液的pH:
溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | C6H5ONa |
pH | 8.1 | 8.8 | 11.6 | 10.3 | 11.1 | 11.3 |
(1)请根据上述信息判断下列反应不能发生的是 (填编号).
A.CH3COOH+NaCN═CH3COONa+HCN
B.CO2+H2O+2NaClO═Na2CO3+2HClO
C.Na2CO3+C6H5OH→NaHCO3+C6H5ONa
D.HCN+Na2CO3→NaCN+CO2+H2O
(2)已知常温时Ksp(AgCl)=1.8×10﹣10mol2•L﹣2 , 向50mL 0.18mol•L﹣1的AgNO3溶液中加入相同体积0.22mol•L﹣1的盐酸,则c(Ag+)= mol/L .
下列叙述正确的是( )
A . CO2的水溶液可以导电,CO2是电解质
B . 硫酸钡难溶于水,但却是电解质
C . 氯化钠溶液在电流的作用下电离成钠离子和氯离子
D . 溶于水后能电离出氢离子的化合物都是酸
下列说法正确的是( )
A . 溶液中水的离子积常数(KW)随溶液浓度的改变而改变
B . 一般情况下,一元弱酸HA的Ka越大,表明该酸的酸性越弱
C . 对已达到化学平衡的反应,改变压强,平衡常数(K)一定改变
D . Ksp只与难溶电解质的性质和温度有关,而与溶液中的离子浓度无关
下列物质中,含有自由移动的Cl-的是( )
A . KCl溶液
B . NaClO3溶液
C . NaCl晶体
D . 液态氯化氢
下列电离方程式错误的是( )
A . HCl→H++Cl-
B . H2CO3 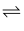 2H++CO32-
C . NaCl→Na++Cl-
D . NH3·H2O
2H++CO32-
C . NaCl→Na++Cl-
D . NH3·H2O 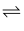 NH4++OH-
NH4++OH-
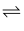 2H++CO32-
C . NaCl→Na++Cl-
D . NH3·H2O
2H++CO32-
C . NaCl→Na++Cl-
D . NH3·H2O 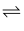 NH4++OH-
NH4++OH-
判断下列说法正确的是( )
A . 强电解质溶液的导电能力一定比弱电解质溶液强
B . 中和等体积、等物质的量浓度的盐酸和醋酸溶液,盐酸所需氢氧化钠等于醋酸
C . 将NaOH和氨水溶液各稀释一倍,两者的OH-浓度均减少到原来的1/2
D . 物质的量相同的磷酸钠溶液和磷酸溶液中所含的PO43-量相同
常温下,用0.01mol•L-1的NaOH溶液滴定20mL同浓度的HCN溶液,滴定曲线如图所示,下列说法正确的是( )

A . Ka(HCN)的数量级为10-8
B . 点①时,向溶液中滴入几滴1mol/L的HCN溶液,溶液中c(H+)/ c(HCN)的值增大
C . 点②时,溶液中微粒浓度大小关系:c(HCN)>c(Na+)>c(CN-)>c(OH-)>c(H+)
D . 在标示的四种情况中,水的电离程度最大的是②
常温下,把0.02 mol/L CH3COOH(Ka=1×10-5 mol/L)溶液和0.01 mol/L NaOH溶液等体积混合,则混合溶液中微粒浓度关系正确的是( )
A . c(CH3COO-)>c(Na+)
B . c(CH3COOH)>c(CH3COO-)
C . c(H+)<c(OH-)
D . c(CH3COOH)+c(CH3COO-)=0.02 mol/L
常温下,甲溶液的pH = 4,乙溶液的pH = 5,甲溶液与乙溶液中由水电离的c(H+)之比不可能是( )
A . 2∶1
B . 10∶1
C . 1∶10
D . 1∶105
下列物质中,含有自由移动的Cl-的是( )
A . KCl晶体
B . 液态氯化氢
C . CaCl2溶液
D . NaClO3溶液
常温下,向100mL0.01mol/LHA溶液中逐滴加入0.02mol/LMOH溶液,混合溶液的pH变化情况如图所示(体积变化忽略不计)。下列有关叙述正确的是( )

A . HA为弱酸
B . N点混合的溶液中,c(M+)=c(A-)=c(H+)=c(OH-)
C . K点的混合溶液中,c(M+)>c(A-)>c(OH-)>c(H+)
D . K点时加水稀释溶液,c(H+)减小
向一定体积的Ba(OH)2溶液中逐滴加入H2SO4溶液,测得混合溶液的导电能力随时间的变化曲线如下图所示。下列说法正确的是( )
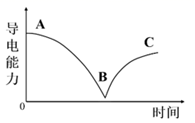
A . AB段溶液的导电能力不断减弱,说明产物BaSO4是非电解质
B . AB段反应的离子方程式为:Ba2++OH-+H++  =BaSO4↓+H2O
C . BC段溶液的导电能力不断增强,说明过量的Ba(OH)2发生电离
D . BC段溶液中:Al3+、Na+、
=BaSO4↓+H2O
C . BC段溶液的导电能力不断增强,说明过量的Ba(OH)2发生电离
D . BC段溶液中:Al3+、Na+、  和Cl-可以大量共存
和Cl-可以大量共存
 =BaSO4↓+H2O
C . BC段溶液的导电能力不断增强,说明过量的Ba(OH)2发生电离
D . BC段溶液中:Al3+、Na+、
=BaSO4↓+H2O
C . BC段溶液的导电能力不断增强,说明过量的Ba(OH)2发生电离
D . BC段溶液中:Al3+、Na+、  和Cl-可以大量共存
和Cl-可以大量共存
下列排序正确的是( )
A . 酸性: 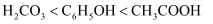 B . 碱性:
B . 碱性: 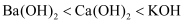 C . 熔点:
C . 熔点: 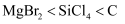 (金刚石)
D . 沸点:
(金刚石)
D . 沸点: 
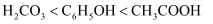 B . 碱性:
B . 碱性: 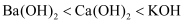 C . 熔点:
C . 熔点: 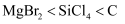 (金刚石)
D . 沸点:
(金刚石)
D . 沸点: 
25℃时,向10mL 0.1 mol∙L−1一元弱碱XOH溶液中逐滴滴加0.1 mol∙L−1的HCl溶液,溶液的变化 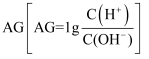 如图所示(溶液混合时体积变化忽略不计)。下列说法正确的是( )
如图所示(溶液混合时体积变化忽略不计)。下列说法正确的是( )
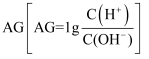 如图所示(溶液混合时体积变化忽略不计)。下列说法正确的是( )
如图所示(溶液混合时体积变化忽略不计)。下列说法正确的是( ) 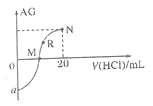
A . a的最小值是−12
B . M点消耗盐酸的体积为10mL
C . R点溶液中可能存在 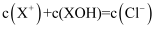 D . M点到N点,水的电离程度逐渐增大
D . M点到N点,水的电离程度逐渐增大
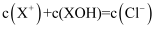 D . M点到N点,水的电离程度逐渐增大
D . M点到N点,水的电离程度逐渐增大
-
(1) 现有以下物质:①Ba(OH)2晶体,②盐酸,③冰醋酸(固态醋酸),④石墨,⑤酒精(C2H5OH),请回答下列问题(填序号):
Ⅰ、以上物质中属于电解质的是。
Ⅱ、以上物质中属于非电解质的是。
Ⅲ、请写出①在水溶液中的电离方程式。
-
(2) 维生素C又称“抗坏血酸”,在人体内有重要的功能。例如,能帮助人体将食物中摄取的、不易吸收的Fe3+转变为易吸收的Fe2+ , 这说明维生素C具有(填“氧化性”或“还原性”)。
-
(3) 当光束通过下列物质时,会出现丁达尔效应的是。
①Fe(OH)3胶体,②水,③蔗糖溶液,④Ca(OH)2悬浊液
-
(4) 用单线桥标出下列反应中电子转移的情况:。
8NH3+6NO2
 7N2+12H2O
7N2+12H2O -
(5) 请写出最恰当的试剂除去括号中的杂质:CO2(HCl)
下列指定体系中氯离子浓度最大的是( )
A . 40mL0.2mol/L 的 KCl 溶液
B . 20mL0.1mol/L 的 FeCl3 溶液
C . 20mL0.5mol/L 的 KClO3 溶液
D . 100mL0.2mol/L CaCl2 溶液与 100mL0.2mol/L 的 Na2CO3 溶液混合后的溶液
常温下,将0.01 mol/L NaOH溶液分别滴入10 mL0.01 mol/LHA和HB溶液中,得到溶液pH随NaOH溶液体积变化的关系如图1和图2。

下列说法错误的是( )
A . HA是强酸,HB是弱酸
B . 由水电离出的c(H+):b<d<e
C . a点与c点溶液:c(A-)>c(B-)
D . c、d、e点溶液均有:c(B-)-c(H+)=c(Na+)-c(OH-)
下列有关电解质溶液的说法正确的是( )
A .  的盐酸中
的盐酸中 B . 常温下,
B . 常温下, 溶液加水稀释时,
溶液加水稀释时, 逐渐增大
C . 25℃时,在
逐渐增大
C . 25℃时,在 的悬浊液中加入少量
的悬浊液中加入少量 固体,
固体, 减小
D . 室温下
减小
D . 室温下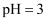 的醋酸溶液和
的醋酸溶液和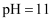 的
的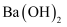 溶液等体积混合后溶液呈酸性
溶液等体积混合后溶液呈酸性
 的盐酸中
的盐酸中 B . 常温下,
B . 常温下, 溶液加水稀释时,
溶液加水稀释时, 逐渐增大
C . 25℃时,在
逐渐增大
C . 25℃时,在 的悬浊液中加入少量
的悬浊液中加入少量 固体,
固体, 减小
D . 室温下
减小
D . 室温下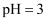 的醋酸溶液和
的醋酸溶液和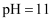 的
的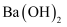 溶液等体积混合后溶液呈酸性
溶液等体积混合后溶液呈酸性
相同温度下,等物质的量浓度的下列溶液中,pH最小的是( )
A .  B .
B .  C .
C .  D .
D . 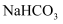
 B .
B .  C .
C .  D .
D . 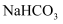
最近更新



