离子反应发生的条件 知识点
离子反应发生的条件:离子在溶液中由于相互反应导致离子浓度减小,而发生反应常见的情况称为发生的条件:生成沉淀、气体、弱电解质及发生氧化还原反应和双水解反应导致不能大量共存。
离子反应发生的条件 知识点题库
下列有关
 溶液的叙述正确的是()
溶液的叙述正确的是()
 溶液的叙述正确的是()
溶液的叙述正确的是()
A . 该溶液中Na+、NH4+、NO3-、Mg2+可以大量共存
B . 通入CO2气体产生蓝色沉淀
C . 与H2S反应的离子方程式:Cu2++ S2-=CuS
D . 与过量浓氨水反应的离子方程式:Cu2++2NH3·H2O=Cu(OH)2↓+2NH4+
在离子浓度都为0.1mol/L的下列溶液中,加入(或通入)某物质后,发生反应先后顺序正确的是( )
A . 在含Fe3+、Cu2+、H+的溶液中加入锌粉:Cu2+、Fe3+、H+
B . 在含I﹣、SO32﹣、Br﹣的溶液中不断通入氯气:I﹣、Br﹣、SO32﹣
C . 在含AlO2﹣、SO32﹣、OH﹣的溶液中逐滴加入硫酸氢钠溶液:OH﹣、AlO2﹣、SO32﹣
D . 在含Fe3+、H+、NH4+的溶液中逐渐加入烧碱溶液:H+、NH4+、Fe3+
无论在酸性溶液还是在碱性溶液中,一定都不能大量存在的离子是( )
A . Al3+
B . K+
C . HS﹣
D . AlO2﹣
将SO2和X气体分别通入BaCl2溶液,未见沉淀生成,若同时通入,有沉淀生成,则X气体不可能是( )
A . CO2
B . NH3
C . Cl2
D . H2S
在复杂的体系中,确认化学反应先后顺序有利于解决问题,下列化学反应先后顺序判断正确的是( )
A . 在含等物质的量的AlO2﹣、OH﹣、CO32﹣的溶液中,逐滴加入盐酸,离子反应发生的先后顺序为 AlO2﹣、OH﹣、CO32﹣
B . 在含等物质的量的Fe3+、Cu2+、H+的溶液中加入锌粉,离子反应发生的先后顺序为:Fe3+、Cu2+、H+、Fe2+
C . 在含等物质的量的Ba(OH)2、KOH的溶液中,缓慢通入CO2 , 离子反应发生的先后顺序为:KOH、Ba(OH)2、K2CO3、BaCO3
D . 在含等物质的量的FeBr2、FeI2的溶液中,缓慢通入氯气,离子反应发生的先后顺序为I﹣、Br﹣、Fe2+
某无色溶液中只含有下列离子中的某几种:Na+、Mg2+、SO42﹣、CO32﹣、Cl﹣、MnO4﹣ . 为了鉴别这些离子,分别取少量溶液进行以下实验:
①加HCl后,生成无色无味的气体.该气体能使澄清石灰水变浑浊.
②加入足量的BaCl2溶液产生白色沉淀,过滤,在沉淀中加入足量的盐酸,沉淀不能完全溶解.滤出沉淀后,继续在滤液中加入HNO3酸化的AgNO3溶液,析出白色沉淀.
根据上述实验,能确定一定存在离子的是,一定不存在的离子是,不能确定是否存在的离子是.
下列物质间不能发生离子反应的是 ( )
A . Na2SO4溶液与BaCl2溶液
B . 铝片插入Hg(NO3)2溶液
C . NaNO3溶液与KCl溶液
D . Na2CO3溶液与稀盐酸
室温下,下列各组离子在指定溶液中能大量共存的是( )
A . 0. 1 mol·L−1KI 溶液:Na+、K+、ClO− 、OH−
B . 0. 1 mol·L−1Fe2(SO4)3溶液:Cu2+、NH4+、NO3−、SO42−
C . 0. 1 mol·L−1HCl 溶液:Ba2+、K+、CH3COO−、NO3−
D . 0. 1 mol·L−1NaOH溶液:Mg2+、Na+、SO42−、HCO3−
下列各组离子能在指定容液中,大量共存的是( )
①无色溶液中:K+、Cl-、Na+、HCO3-、CO32-、SO42-
②使pH>7的溶液中: CO32-、Na+、NO3-、SO42-、K+
③溶液中c(H+)=4mol·L-1的溶液中:Cl-、HCO3-、NO3-、NH4+
④在强碱溶液中:Na+、K+、CO32-、NO3-
⑤有SO42-存在的溶液中:Na+、Mg2+、Ca2+、I-
⑥有无色的酸性溶液中:K+、Cu2+、Cl-、SO42-
A . ①②④⑤
B . ①③⑥
C . ②④⑤⑥
D . ①②④
-
(1) 下列实验基本操作或说法正确的是(填写序号)
A.金属钠着火时使用泡沫灭火器灭火
B.为了有效地除去粗盐中的Ca2+ 、Mg2+ 、SO42- , 可先加入NaOH,再加入BaCl2 , 最后加入Na2CO3 , 将沉淀过滤后,再用HCl调整溶液至中性
C.为测定新制氯水的pH,用玻璃棒蘸取液体滴在pH试纸上,与标准比色卡对照即可
D.稀释浓硫酸时,应将水沿器壁缓缓加入浓硫酸中,并不断用玻璃棒搅拌
E.容量瓶中含有少量蒸馏水,对配制一定物质的量浓度的硫酸溶液无影响
F.金属汞一旦洒落在实验室地面或桌面时,必须尽可能收集,并深埋处理
G.在粗盐的提纯实验中,溶解、过滤、蒸发都用到了玻璃棒
H.用试管加热碳酸氢钠固体时使试管口竖直向上
-
(2) 有一包白色固体,可能含有CaCO3、Na2SO4、KNO3、CuSO4、BaCl2五种物质中的一种或几种。现进行如下实验:①取少量固体粉末,加入盛有足量水的烧杯中,充分搅拌静置后,底部白色沉淀,上层为无色溶液;②继续往烧杯中加入足量稀硝酸,白色沉淀完全消失;并有气泡产生。③取少量②中溶液滴加Ba(NO3)2溶液,有白色沉淀生成,再加入稀硝酸,沉淀不溶解。
根据以上实验现象可知,该白色固体中一定含有,(填化学式,下同)一定不含有,可能含有。
下列反应的离子方程式书写正确的是( )
A . Na2CO3 溶液中滴入少量盐酸:CO32-+2H+→CO2↑+H2O
B . 铁粉与稀 H2SO4反应:2Fe+6H+→2Fe3++3H2↑
C . Cu(OH)2与稀 H2SO4反应:OH-+H+→ H2O
D . 氯气与氢氧化钠溶液反应 Cl2+2OH‾→ClO‾+Cl‾+H2O
向明矾溶液中逐滴加入Ba(OH)2溶液,当SO42-全部沉淀时,铝元素的主要存在形式为( )
A . Al3+
B . AlO2-
C . Al(OH)3
D . Al(OH)3、AlO2-
向X溶液中加入Y试剂,产生沉淀或气体如图,与所述情形几乎完全相符的是( )
A . 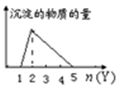 向HCl和AlCl3的混合液滴加NaOH溶液
B .
向HCl和AlCl3的混合液滴加NaOH溶液
B . 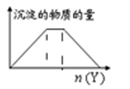 向NH4Al(SO4)2 溶液滴加 Ba(OH)2溶液
C .
向NH4Al(SO4)2 溶液滴加 Ba(OH)2溶液
C .  向NaOH和Ca(OH)2混合液中通入CO2
D .
向NaOH和Ca(OH)2混合液中通入CO2
D . 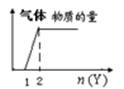 向NaOH和Na2CO3混合液滴加稀HCl溶液
向NaOH和Na2CO3混合液滴加稀HCl溶液
 向HCl和AlCl3的混合液滴加NaOH溶液
B .
向HCl和AlCl3的混合液滴加NaOH溶液
B .  向NH4Al(SO4)2 溶液滴加 Ba(OH)2溶液
C .
向NH4Al(SO4)2 溶液滴加 Ba(OH)2溶液
C .  向NaOH和Ca(OH)2混合液中通入CO2
D .
向NaOH和Ca(OH)2混合液中通入CO2
D .  向NaOH和Na2CO3混合液滴加稀HCl溶液
向NaOH和Na2CO3混合液滴加稀HCl溶液
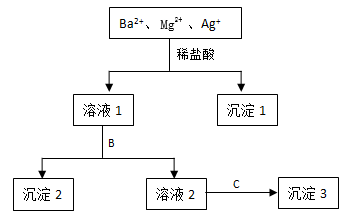
某溶液中只含有Ba2+ Mg2+
Ag+三种阳离子,现用适量的NaOH溶液、稀盐酸和Na2SO4溶液将这三种离子逐一沉淀分离,其流程如图所示:
-
(1) 沉淀1的化学式为,生成该沉淀的离子方程式为。
-
(2) 若试剂B为Na2SO4溶液,则沉淀2化学式为。
-
(3) 若试剂B为NaOH溶液,则生成沉淀2的离子方程式为。
-
(4) 如果原溶液中Ba2+ Mg2+ Ag+的浓度均为0.1 mol·L-1 , 且溶液中含有的阴离子只有NO3- , 则溶液中NO3- 浓度为mol·L-1。
某溶液可能含有较高浓度的Fe3+、Fe2+、H+、Al3+、AlO2-、NO3-、SO32-中的几种。向该溶液逐滴加入NaOH溶液,开始不出现沉淀,加入一定量后才有沉淀产生。对该溶液的判断正确的是( )
A . 溶液中可能含有AlO2-
B . 溶液中一定不含Fe3+和Fe2+
C . 溶液中一定不含有NO3-
D . 溶液中可能含有Fe3+ , 但一定不含Fe2+
下列物质中既能与稀H2SO4反应,又能与NaOH溶液反应的是( )
①NaHCO3 ②Al2O3 ③Al ④Na2CO3 ⑤NaHSO4
A . ②③④
B . ①②③
C . ①③④
D . 全部
下列说法正确的是( )
A . 离子反应中反应物和生成物都是离子
B . 有单质参加或生成的反应一定属于氧化还原反应
C . 金属氧化物不一定是碱性氧化物,酸酐不一定是酸性氧化物
D . 金属单质只能做还原剂,非金属单质只能做氧化剂
下列实验设计及其对应的离子方程式均正确的是( )
A . 将氯气溶于水制备次氯酸: Cl2+H2O = 2H+ Cl-+ ClO-
B . Na2O2与H2O反应制备O2: Na2O2+H2O = 2Na++ 2OH-+ O2↑
C . 用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:2MnO  + 6H++ 5H2O2 = 2Mn2++ 5O2↑+ 8H2O
D . 用FeCl3溶液腐蚀铜线路板: Cu+2Fe3+ = Cu2+ +2Fe2+
+ 6H++ 5H2O2 = 2Mn2++ 5O2↑+ 8H2O
D . 用FeCl3溶液腐蚀铜线路板: Cu+2Fe3+ = Cu2+ +2Fe2+
 + 6H++ 5H2O2 = 2Mn2++ 5O2↑+ 8H2O
D . 用FeCl3溶液腐蚀铜线路板: Cu+2Fe3+ = Cu2+ +2Fe2+
+ 6H++ 5H2O2 = 2Mn2++ 5O2↑+ 8H2O
D . 用FeCl3溶液腐蚀铜线路板: Cu+2Fe3+ = Cu2+ +2Fe2+
下列反应的离子方程式书写正确的是( )
A . 向Na2SO3 溶液中滴加碘水SO  +I2+H2O=SO
+I2+H2O=SO  +2I-+2H+
B . Na2SO3与稀HNO3反应,Na2SO3+2HNO3=2NaNO3+H2O+SO2↑
C . HNO3溶液与氨水反应:H++OH-=H2O
D . 铜与浓硝酸的反应:3Cu+8H++2NO
+2I-+2H+
B . Na2SO3与稀HNO3反应,Na2SO3+2HNO3=2NaNO3+H2O+SO2↑
C . HNO3溶液与氨水反应:H++OH-=H2O
D . 铜与浓硝酸的反应:3Cu+8H++2NO  =3Cu2++2NO2↑+4H2O
=3Cu2++2NO2↑+4H2O
 +I2+H2O=SO
+I2+H2O=SO  +2I-+2H+
B . Na2SO3与稀HNO3反应,Na2SO3+2HNO3=2NaNO3+H2O+SO2↑
C . HNO3溶液与氨水反应:H++OH-=H2O
D . 铜与浓硝酸的反应:3Cu+8H++2NO
+2I-+2H+
B . Na2SO3与稀HNO3反应,Na2SO3+2HNO3=2NaNO3+H2O+SO2↑
C . HNO3溶液与氨水反应:H++OH-=H2O
D . 铜与浓硝酸的反应:3Cu+8H++2NO  =3Cu2++2NO2↑+4H2O
=3Cu2++2NO2↑+4H2O
化学反应中,反应物用量或反应条件不同,可能对生成物产生影响。下列反应的生成物不受上述因素影响的是( )
A . KAl(SO4)2溶液和Ba(OH)2溶液
B . FeCl3溶液和锌反应
C . NaOH溶液和Ca(HCO3)2溶液
D . 铁粉和氯气反应
最近更新



