离子反应发生的条件 知识点题库
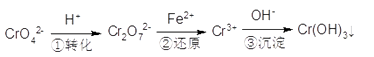
某同学采用硫铁矿焙烧取硫后的烧渣(主要成分为Fe2O3、SiO2、Al2O3 , 不考虑其他杂质)制取七水合硫酸亚铁(FeSO4·7H2O),设计了如下流程:
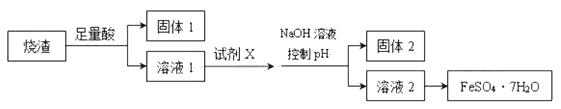
下列说法不正确的是( )
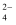 、Cl-
B . H+、Mg2+、CO
、Cl-
B . H+、Mg2+、CO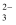 、S2-
C . K+、Mg2+、SO
、S2-
C . K+、Mg2+、SO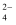 、NO
、NO D . K+、Na+、NO
D . K+、Na+、NO 、SO
、SO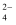

请回答下列问题
-
(1) 写出NaHSO4溶液中,NaHSO4的电离方程式.
-
(2) 图中①、②分别代表滴加哪种溶液的变化曲线①.
-
(3) b点,溶液中大量存在的离子是.
-
(4) a、b两点对应的溶液显(填“酸性”“中性”或“碱性”)
-
(5) 曲线②中d点导电能力最弱的原因是(用化学方程式表示)
-
(6) c点,两溶液中含有相同量的哪种离子.

已知:①NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出产品NaClO2•3H2O;
②纯ClO2易分解爆炸,一般用稀有气体或空气稀释到10%以下。
-
(1) 发生器中鼓入空气的作用可能是。
a.将SO2氧化成SO3 , 增强酸性
b.将NaClO3还原为ClO2
c.稀释ClO2以防止爆炸
-
(2) 吸收塔内发生反应的化学方程式为。
-
(3) 吸收塔中为防止NaClO2被还原成NaCl,需加的试剂可以选用的是(填序号)。
a.Na2O2
b.Na2S
c.FeCl2
-
(4) 从滤液中得到NaClO2·3H2O粗晶体的实验操作依次是。
-
(5) 某学习小组用碘量法测定粗产品中亚氯酸钠的含量,实验如下:
a.准确称取所得亚氯酸钠样品m g于小烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应,将所得混合液配成250 ml待测溶液。(已知:ClO2+4I-+4H+=2H2O+2I2+Cl-)
b.移取25.00 ml待测溶液于锥形瓶中,加几滴淀粉溶液,用c mol·L-1 Na2S2O3标准液滴定至终点,重复2次,测得平均值为V ml 。(已知:I2+2S2O32-=2I-+S4O62-)
①达到滴定终点时的现象为。
②该样品中NaClO2的质量分数为(用含m、c、V的代数式表示,结果化成最简)
物质 | 现象 | 解释 | |
A | SO2 | 溶液变为浅绿色 | 2Fe3+ + SO2 + 2H2O= 2Fe2+ + SO42- + 4H+ |
B | 氨水 | 有红褐色沉淀产生 | Fe3+ + 3OH- = Fe(OH)3↓ |
C | NaHCO3溶液 | 有红褐色沉淀产生,并伴有无色气泡 | Fe3+ + 3HCO3- = Fe(OH)3↓ + 3CO2↑ |
D | Mg(OH)2浊液 | 有红褐色沉淀产生 | 3Mg(OH)2(s)+ 2Fe3+(aq)= 2Fe(OH)3(s)+3Mg2+(aq) |
-
(1) 制备该工艺流程需用Fe2+
甲同学方案:
用部分生锈的废铁屑与稀硫酸反应制备Fe2+ , 检验溶液中是否含有Fe3+试剂是()。
A.铁氰化钾
B.硫氰化钾
C.酸性高锰酸钾溶液
制备中除发生反应Fe+2H+ = Fe2++H2↑外,其他可能反应的离子方程式为。
乙同学方案:
把一块纯净的铁片插入装有稀硫酸的烧杯里,可观察到铁片上有气泡,在平行插入一块铜片,可观察到铜片上(填“有”或“没有”)气泡产生,再用导线把铁片和铜片连接起来,组成一个原电池,正极的电极反应式为。
-
(2) 工艺流程中第①步存在平衡:2CrO42-(黄色)+2H+
 Cr2O72-(橙色)+H2O,若平衡体系的pH=2,则溶液显色。
Cr2O72-(橙色)+H2O,若平衡体系的pH=2,则溶液显色。
-
(3) 工艺流程中第②步中,还原1mol Cr2O72-离子,需要mol的FeSO4·7H2O。
-
(4) 工艺流程中第③步生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:
Cr(OH)3(s)
 Cr3+(aq)+3OH-(aq)
Cr3+(aq)+3OH-(aq)常温下,Cr(OH)3的溶度积Ksp=10-32 , 要使c(Cr3+)降至10-5mol/L,溶液的pH应调至。
-
(5) 已知AgCl、Ag2CrO4(砖红色)的Ksp分别为2×10-10和2.0×10−12。分析化学中,测定含氯的中性溶液中Cl-的含量,以K2CrO4作指示剂,用AgNO3溶液滴定。滴定过程中首先析出沉淀,当溶液中Cl−恰好完全沉淀(浓度等于1.0×10−5 mol·L−1)时,此时溶液中c(CrO42−)等于 mol·L−1。
①该溶液与Al2O3反应后有Al3+生成,则原溶液中一定含有,一定不会含有大量的。
②该溶液与Al2O3反应后有AlO2-生成,则原溶液中一定含有,可能含有大量的。
③写出该溶液与Al2O3反应生成AlO2-的离子方程式。
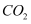 通入下列溶液中,最终会出现浑浊的是( )
通入下列溶液中,最终会出现浑浊的是( )
 溶液
B . 澄清石灰水
C . 饱和
溶液
B . 澄清石灰水
C . 饱和  溶液
D .
溶液
D .  溶液
溶液

已知:步骤①中,滴加NaOH溶液过程中产生的沉淀会部分溶解。下列说法中正确的是( )
-
(1) SO2是一种酸性氧化物。工业上,可用足量的稀氨水吸收少量SO2 , 写出发生反应的离子方程式:。
-
(2) SO2具有较强的还原性,能使酸性高锰酸钾溶液褪色,反应中被还原的元素是(填元素符号)。
-
(3) 某硫酸厂每天排放1.12×104m3(标准状况)尾气,其中含0.2%(体积分数)的SO2。现用浓度为0.5 mol/L的NaOH废碱液(假设其他成分不参与反应)进行处理,每天至少需要这种废碱液的体积为L。
-
(4) 某同学向BaCl2溶液中通入SO2 , 未观察到有白色沉淀生成。取上述所得溶液进行下列操作,依然不能观察到有白色沉淀生成的是____(填标号)。A . 通入Cl2 B . 滴加稀硝酸 C . 滴加稀盐酸 D . 滴加NaOH溶液
-
(5) 硫酸是用途广泛的化工原料,可作脱水剂、吸水剂、氧化剂和催化剂等。甲、乙两位同学用铜和硫酸作原料,设计了两种制取硫酸铜的方案。
方案甲:铜与浓硫酸加热直接反应,即Cu→CuSO4
方案乙:Cu→CuO→CuSO4
①方案甲中,铜和浓硫酸发生反应的化学方程式是。
②这两种方案,你认为哪一种方案更合理?。理由是。



