离子反应发生的条件 知识点题库
将铁粉放入由盐酸、MgCl2溶液、FeCl3溶液、CuCl2溶液组成的混合液中,充分反应后,铁粉有剩余,则溶液含有大量的阳离子是
A . Cu2+和Fe2+
B . H+和Cu2+
C . Fe3+和Fe2+
D . Fe2+和Mg2+
在Na+浓度为0.5mol•L﹣1的某澄清溶液中,还可能含有下表中的若干种离子.
(已知H2SiO3为不溶于水的胶状沉淀,加热时易分解为两种氧化物)
阳离子 | K+ | Ag+ | Ca2+ | Ba2+ |
阴离子 | NO | CO | SiO | SO |
现取该溶液100mL进行如下实验(气体体积均在标准状况下测定).
序号 | 实验内容 | 实验结果 |
Ⅰ | 向该溶液中加入足量稀盐酸 | 产生白色胶状沉淀并放出标准状况下0.56L气体 |
Ⅱ | 将Ⅰ的反应混合液过滤,对沉淀洗涤、灼烧至恒重,称量所得固体质量 | 固体质量为2.4g |
Ⅲ | 向Ⅱ的滤液中滴加BaCl2溶液 | 无明显现象 |
请回答下列问题.
-
(1) 实验Ⅰ能确定一定不存在的离子是;
-
(2) 实验Ⅰ中生成气体的离子方程式为;
-
(3) 通过实验Ⅰ、Ⅱ、Ⅲ和必要计算,填写下表中阴离子的浓度(能计算出的,填写计算结果,一定不存在的离子填“0”,不能确定是否存在的离子填“?”).
阴离子
NO

CO

SiO

SO

c/mol•L﹣1
下列化合物与小苏打溶液反应,没有气体或沉淀生成的是( )
A . 烧碱
B . 硫酸氢钠
C . 氢氧化钡
D . 过氧化钠
向下列物质的溶液中通入CO2 , 不发生反应的是( )
A . Na2CO3
B . NaOH
C . Na2SiO3
D . CaCl2
将0.1摩尔镁、铝混合物粉末溶于200mL0.5mol/L的硫酸中,反应一段时间后,再加入150mL2mol/L的氢氧化钠溶液,待反应完全,此时溶液中大量存在的是( )
A . Na+ , Mg2+
B . Na+ , AlO2﹣
C . Mg2+ , AlO2﹣
D . Al3+ , Mg2+
某溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42﹣等离子,当向该溶液中加入某浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化如图所示.下列有关对该溶液的判断不正确的是( )
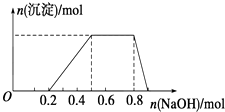
A . 该溶液中肯定含有的离子是H+、NH4+、Al3+、SO42﹣
B . 肯定不含的阳离子是Mg2+、Fe3+
C . 要确定该溶液是否含有Na+ , 必须做焰色反应实验,看焰色是否为黄色
D . 该溶液中肯定含有的离子的物质的量之比为n(H+):n(NH4+):n(Al3+):n(SO42﹣)=2:3:1:4
将HCl、H2SO4、Ba(NO3)2三种溶液,按一定顺序滴入到Na2CO3溶液中至恰好完全反应有以下现象:
①加入A时生成白色沉淀;
②往①沉淀中加入B时沉淀溶解,并有气体逸出;
③往②生成的溶液中加入C时,又有白色沉淀生成.
根据上述现象,回答:
-
(1) A,B,C各是什么溶液?(填溶质的化学式)
A. B. C.
-
(2) 写出上述①②反应的离子方程式..
解释下列事实的方程式正确的是( )
A . 纯碱溶液显碱性:CO32-+2H2O  H2CO3+2OH-
B . 用稀硝酸清洗试管内壁附着的银:Ag+2H++NO3-=Ag++NO2↑+H2O
C . 向煤中加入石灰石可减少煤燃烧时SO2的排放:CaCO3+O2+SO2= CO2+CaSO4
D . 碳酸氢钠溶液与过量澄清石灰水混合出现白色沉淀:HCO3-+Ca2++OH-=CaCO3↓+H2O
H2CO3+2OH-
B . 用稀硝酸清洗试管内壁附着的银:Ag+2H++NO3-=Ag++NO2↑+H2O
C . 向煤中加入石灰石可减少煤燃烧时SO2的排放:CaCO3+O2+SO2= CO2+CaSO4
D . 碳酸氢钠溶液与过量澄清石灰水混合出现白色沉淀:HCO3-+Ca2++OH-=CaCO3↓+H2O
 H2CO3+2OH-
B . 用稀硝酸清洗试管内壁附着的银:Ag+2H++NO3-=Ag++NO2↑+H2O
C . 向煤中加入石灰石可减少煤燃烧时SO2的排放:CaCO3+O2+SO2= CO2+CaSO4
D . 碳酸氢钠溶液与过量澄清石灰水混合出现白色沉淀:HCO3-+Ca2++OH-=CaCO3↓+H2O
H2CO3+2OH-
B . 用稀硝酸清洗试管内壁附着的银:Ag+2H++NO3-=Ag++NO2↑+H2O
C . 向煤中加入石灰石可减少煤燃烧时SO2的排放:CaCO3+O2+SO2= CO2+CaSO4
D . 碳酸氢钠溶液与过量澄清石灰水混合出现白色沉淀:HCO3-+Ca2++OH-=CaCO3↓+H2O
下列反应的离子方程式书写正确的是( )
A . 钠和冷水反应:Na+2H2O=Na++2OH-+H2↑
B . 氯气通入溴化钾溶液:Cl2+2Br-=Br2+2Cl-
C . 铁跟稀硫酸反应:2Fe+6H+=2Fe3++3H2↑
D . 稀硫酸和氢氧化铜反应:H++OH-=H2O
下列化合物中,能与Na2CO3溶液反应生成沉淀且沉淀可溶于NaOH溶液的是( )
A . MgCl2
B . Ca(NO)3
C . FeSO4
D . AlCl3
某无色透明酸性溶液中,能大量共存的离子组是( )
A . Na+﹑Ca2+﹑Cl-﹑CO32-
B . Na+、Ca2+、HCO3-、NO3-
C . Cu2+﹑Cl-﹑Ca2+﹑NO3-
D . NO3-﹑Na+﹑Ca2+﹑Cl-
能正确表示下列反应的离子方程式是( )
A . 将铁粉加入稀硫酸中2Fe+6H+=2Fe3++3H2↑
B . 向碳酸镁中加入稀盐酸:CO32-+2H+=CO2↑+H2O
C . 将铜屑加Fe3+溶液中2Fe3++Cu=2Fe2++Cu2+
D . 将氯化亚铁溶液和稀硝酸混合Fe2++4H++NO3﹣=Fe3++2H2O+NO↑
下列各组物质间的反应中,不属于离子反应的是( )
A . Zn和H2SO4(稀)反应
B . NaCl溶液和AgNO3溶液反应
C . C和O2反应
D . Fe和CuSO4溶液反应
依据下列方程式得出的结论错误的是( )
A . C(石墨,s)=C(金刚石,s) △H>0,说明石墨比金刚石稳定
B . NH3+H3O+=NH4++H2O,说明NH3结合H+能力比H2O强
C . 2HCl+CaCO3=CaCl2+CO2↑+H2O,说明盐酸是强酸
D . CH3COO-+H2O  CH3COOH+OH- , 说明CH3COOH是弱电解质
CH3COOH+OH- , 说明CH3COOH是弱电解质
 CH3COOH+OH- , 说明CH3COOH是弱电解质
CH3COOH+OH- , 说明CH3COOH是弱电解质
已知Fe2+可以水解: Fe2+ +2H2O  Fe(OH)2+2H+ , 现向Fe(NO3)2溶液中加入足量的稀硫酸,则溶液的颜色( )
Fe(OH)2+2H+ , 现向Fe(NO3)2溶液中加入足量的稀硫酸,则溶液的颜色( )
 Fe(OH)2+2H+ , 现向Fe(NO3)2溶液中加入足量的稀硫酸,则溶液的颜色( )
Fe(OH)2+2H+ , 现向Fe(NO3)2溶液中加入足量的稀硫酸,则溶液的颜色( )
A . 浅绿色加深
B . 颜色变浅
C . 溶液变黄
D . 无法判断
以水为溶剂进行中和滴定的原理是:H3O++OH-=2H2O。已知液态SO2和纯水的导电性相近,因为液态SO2也会发生自离解:SO2(l)+SO2(l)  SO32-+SO2+。若以液态SO2为溶剂,用SOCl2滴定Cs2SO3 , 则以下叙述错误的是( )
SO32-+SO2+。若以液态SO2为溶剂,用SOCl2滴定Cs2SO3 , 则以下叙述错误的是( )
 SO32-+SO2+。若以液态SO2为溶剂,用SOCl2滴定Cs2SO3 , 则以下叙述错误的是( )
SO32-+SO2+。若以液态SO2为溶剂,用SOCl2滴定Cs2SO3 , 则以下叙述错误的是( )
A . 该滴定反应可以表示为:SO32-+ SO2+=2SO2
B . 在一定温度下,液态SO2中c(SO32-)与c(SO2+)的乘积是一个常数
C . 自离解的存在,说明SO2是离子化合物
D . 可通过导电能力变化来判断是否到达滴定终点
下列离子方程式中正确的是( )
A . 稀盐酸滴在石灰石上:CaCO3+2H+=Ca2++ H2CO3
B . 硝酸银溶液与盐酸的反应:Ag++Cl-=AgCl↓
C . 铜片插入硝酸银溶液中Cu+Ag+=Cu2++Ag
D . 氧化铜与稀硫酸的反应:CuO+2H++SO42-=CuSO4+H2O
能证明亚硝酸是弱酸的实验事实是( )
A . HNO2的酸性比CH3COOH强
B . 0.1mol/LNaNO2溶液的pH大于7
C . HNO2溶液与Na2CO3反应生成CO2
D . HNO2不稳定可分解成NO和NO2
某溶液中可能含有Na+、  、Fe2+、K+、I-、
、Fe2+、K+、I-、  、
、  ,且所有离子物质的量浓度相等。向该无色溶液中滴加少量氯水,溶液仍呈无色。下列关于该溶液的判断正确的是( )
,且所有离子物质的量浓度相等。向该无色溶液中滴加少量氯水,溶液仍呈无色。下列关于该溶液的判断正确的是( )
 、Fe2+、K+、I-、
、Fe2+、K+、I-、  、
、  ,且所有离子物质的量浓度相等。向该无色溶液中滴加少量氯水,溶液仍呈无色。下列关于该溶液的判断正确的是( )
,且所有离子物质的量浓度相等。向该无色溶液中滴加少量氯水,溶液仍呈无色。下列关于该溶液的判断正确的是( )
A . 肯定不含I-
B . 肯定含有  、I-
C . 肯定不含
、I-
C . 肯定不含  D . 肯定含有
D . 肯定含有 
 、I-
C . 肯定不含
、I-
C . 肯定不含  D . 肯定含有
D . 肯定含有 
为从粗食盐水中除去Ca2+、Mg2+、SO42-等离子,以制得精盐水。某同学设计如下方案:
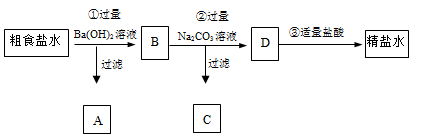
以下说法正确的是( )
A . A中主要有Mg(OH)2和BaSO4 , 也可能有一些Ca(OH)2
B . ②中加入过量Na2CO3溶液的主要目的是为了除去Mg2+、Ca2+
C . D中有CO32-、Cl- 、Na+ 这3种离子
D . ③中发生的反应只有2H++CO32-= H2O +CO2↑
最近更新



