卤素原子结构及其性质的比较 知识点题库
氟、氯、溴、碘四种元素,下列有关它们的性质递变规律的说法不正确的是( )
A . 单质的密度依次增大
B . 单质的熔点和沸点依次升高
C . Cl2可以从KI溶液中置换出I2
D . Br2可以从NaCl溶液中置换出Cl2
关于卤素的叙述中,正确的是( )
A . 气态氢化物水溶液的酸性依次减弱
B . 氯水、溴水、碘水都能使淀粉碘化钾试纸变蓝
C . 气态氢化物的稳定性随原子序数的增大而增强
D . 原子核外最外层电子数随原子序数的增大而增多
下表中的数据是破坏1 mol化学键所消耗的能量.
物质 | Cl2 | Br2 | I2 | H2 | HF | HCl | HBr | HI |
能量(kJ) | 243 | 193 | 151 | 436 | 565 | 431 | 363 | 297 |
根据上述数据回答(1)~(4)题.
-
(1) 下列物质本身具有的能量最低的是A . H2 B . Cl2 C . Br2 D . I2
-
(2) 下列氢化物中,最稳定的是A . HF B . HCl C . HBr D . HI
-
(3) X2+H2═2HX(X代表F、Cl、Br)的反应是吸热反应还是放热反应:
-
(4) 相同条件下,X2(X代表F、Cl、Br)分别与氢气反应,当消耗等物质的量的氢气时,放出或吸收的热量最多的是
某研究性学习小组设计了一组实验来探究元素周期律.甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图1装置来一次性完成同主族元素碳与硅的非金属性强弱比较的实验研究;乙同学设计了如图2装置来验证卤族元素性质的递变规律,A、B、C三处分别是沾有NaBr溶液的棉花、湿润的淀粉KI试纸、湿润的红色试纸.已知常温下浓盐酸与高锰酸钾能反应生成氯气.
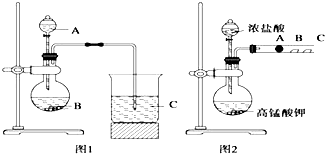
-
(1) 根据图1回答:
写出选用物质的名称:A,B,C
-
(2) 烧瓶中反应的离子方程式为,
-
(3) 根据图2回答:
乙同学的实验原理是,
-
(4) B处的实验现象是;
-
(5) B处的反应的离子方程式:.
-
(6) 有同学认为甲同学的实验设计有明显的不足,你认为不足之处为.
卤素是最活泼的一族非金属元素,下列关于卤素(用X表示)的叙述正确的是( )
A . 单质均能与水反应生成HXO
B . 从上到下,HX的氧化性增强,对应水溶液酸性增强
C . 从上到下,卤素原子的电子层数依次增多,原子半径依次增大
D . 卤素均能形成最高价含氧酸,其分子通式为HXO4
下列曲线表示卤素元素某种性质随核电荷数的变化趋势,正确的是( )
A .  B .
B .  C .
C .  D .
D . 
 B .
B .  C .
C .  D .
D . 
溴的氧化性介于氯和碘之间.利用这一性质判断,下列说法正确的是( )
A . Cl﹣、I﹣离子加入到含Br﹣的溶液中,均可以将Br﹣氧化为Br2
B . 将Cl2缓慢通入含有相同物质的量浓度的Br﹣、I﹣的混合溶液中,Br﹣先被氧化
C . 湿润的淀粉碘化钾试纸遇到氯气会变蓝色
D . 在KBr溶液中加入碘水,发生如下反应:2Br﹣+I2=2I﹣+Br2
某研究性学习小组设计了一组实验来探究元素周期律.甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图1装置来一次性完成同主族元素碳与硅的非金属性强弱比较的实验研究;乙同学设计了如图2装置来验证卤族元素性质的递变规律,A、B、C三处分别是沾有NaBr溶液的棉花、湿润的淀粉KI试纸、湿润的红色试纸.已知常温下浓盐酸与高锰酸钾能反应生成氯气.根据图1回答:

-
(1) 写出选用物质的名称:A,B,C
-
(2) 烧瓶中反应的离子方程式为,
-
(3) 根据图2回答:
乙同学的实验原理是,
-
(4) B处的实验现象是;
-
(5) B处的反应的离子方程式:.
-
(6) 有同学认为甲同学的实验设计有明显的不足,你认为不足之处为.
下列关于卤素的叙述,正确的是( )
A . 单质的颜色随核电荷数的增加逐渐加深
B . 氢化物的稳定性随核电荷数的增加逐渐增强
C . 单质与水反应均可表示为 X2+H2O=HX+HXO
D . 随核电荷数的增加 X﹣的半径递增,还原性递减
下列说法中,不正确的是( )
①建国60周年庆典晚会上,天安门广场燃放的焰火是某些金属元素魅力的展现
②酒精灯加热铝箔至熔化,铝并不滴落,说明铝表面有一层致密的氧化膜
③为测定熔融氢氧化钠的导电性,将氢氧化钠固体放在石英坩埚中加热熔化
④电解从海水中得到的氯化镁溶液可获得金属镁
⑤KI淀粉溶液中通入Cl2 , 溶液变蓝,说明Cl2能与淀粉发生显色反应.
A . ③④⑤
B . ①③④
C . ①③④⑤
D . ①②③④
请回答:
-
(1) H2O2的电子式.
-
(2) 镁燃烧不能用CO2灭火,用化学方程式表示其理由
-
(3) 在AgCl沉淀中加入KBr溶液,白色沉淀转化为淡黄色沉淀,写出反应的离子方程式.
-
(4) 完成以下氧化还原反应的离子方程式:
MnO4﹣+C2O42﹣+=Mn2+CO2↑+.
向NaBr、NaI的混合溶液通入足量的氯气,加热将溶液蒸干,并再灼热片刻,最后残留的物质可能是( )
A . NaCl、NaBr、I2
B . NaCl
C . NaBr、NaI
D . NaCl、Br2、I2 .
下列关于卤素的叙述说法错误的是( )
A . 单质的颜色随核电荷数的增加逐渐加深
B . 元素的最高化合价均为+7
C . 从上到下原子半径递增
D . 从上到下非金属性减弱
下列单质氧化性最强的是( )
A . F2
B . Cl2
C . Br2
D . I2
卤族元素包括F、Cl、Br、I等.
-
(1) 基态Br原子的核外电子排布式为,其价电子层成对与未成对电子个数比为
-
(2) 下列曲线表示卤族元素某种性质随核电荷数的变化趋势,正确的是

-
(3) BCl3中心原子的杂化方式为,NCl3分子的空间构型为;第一电离能介于B、N之间的第二周期元素有(填元素符号).
为探究某橙色含结晶水的盐 X的组成和性质,设计并完成如下实验。请回答:

-
(1) X的化学式是
-
(2) 乙与 KI反应的化学方程式为:
-
(3) 乙化学性质与其组成元素的单质相似,下列物质中能与乙发生反应的是A . Mg B . CaCl2 C . NaOH D . K2SO4
下列对卤素的说法不符合递变规律的是()
A . F2、Cl2、Br2、I2的氧化性逐渐减弱
B . HF、HCl、HBr、HI的热稳定性逐渐增强
C . F-、Cl-、Br-、I-的还原性逐渐増强
D . 卤素单质按F2、Cl2、Br2、I2的顺序颜色逐渐变深,密度逐渐增大
下列说法正确的是( )
A . F2、Cl2、Br2、I2单质的熔点逐渐降低
B . Li、Na、K、Rb单质密度逐渐增大
C . 水分子很稳定是因为分子间有氢键
D . 熔融AlCl3不导电,说明其为共价化合物
海水中的溴元素以Br-形式存在,工业上用“吹出法”从海水中提取溴的工艺流程如下图。
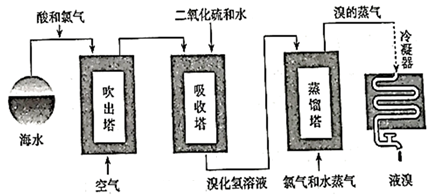
请回答下列问题:
-
(1) 氯气与海水中的Br-发生反应的离子方程式是。
-
(2) 吹出塔中用热空气吹出Br2 , 是利用了Br2的_______(填序号)。A . 氧化性 B . 还原性 C . 挥发性 D . 腐蚀性
-
(3) 吸收塔中用SO2的水溶液吸收Br2 , 吸收率可达95%,有关反应的化学方程式是,其中的氧化剂是。
-
(4) 蒸馏塔中再次通入氯气的目的是。
-
(5) 在整个生产过程中应注意解决的问题是。
下列关于卤素单质的性质说法不正确的是( )
A .  、
、 、
、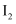 的颜色依次加深
B .
的颜色依次加深
B .  、
、 、
、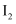 的熔、沸点依次升高
C .
的熔、沸点依次升高
C .  、
、 、
、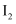 的氧化性依次增强
D .
的氧化性依次增强
D .  、
、 、
、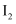 的密度依次增大
的密度依次增大
 、
、 、
、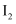 的颜色依次加深
B .
的颜色依次加深
B .  、
、 、
、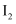 的熔、沸点依次升高
C .
的熔、沸点依次升高
C .  、
、 、
、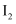 的氧化性依次增强
D .
的氧化性依次增强
D .  、
、 、
、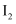 的密度依次增大
的密度依次增大
最近更新



