卤素原子结构及其性质的比较 知识点题库
甲、乙、丙三种溶液中各含有一种X-(X-为Cl-、Br-、I-),向甲中加入淀粉溶液和氯水,则溶液变为棕黄色,再加丙溶液,颜色无明显变化,则甲、乙、丙中依次含有 ( )
A . Br-、Cl-、I-
B . Br-、I-、Cl-
C . I-、Br-、Cl-
D . Cl-、I-、Br-
砹(At)是原子序数最大的卤族元素,对砹及其化合物的叙述,正确的是( )
A . 与H2化合的能力:At2>I2
B . 砹在常温下为白色固体
C . 砹原子的最外层有7个电子
D . 砹易溶于水,难溶于四氯化碳
多原子分子氰(CN)2、硫氰(SCN)2和(OCN)2的性质与卤素单质相似,故称它们为拟卤素.它们可以生成酸和盐(见下表,表中X代表F、Cl、Br或I).
卤素 | 氰 | 硫氰 | ① | |
“单质” | X2 | (CN)2 | (SCN)2 | (OCN)2 |
酸 | HX | HCN | ② | HOCN |
盐 | KX | KCN | KSCN | ③ |
-
(1) 在表中①②③空格处应分别填写
-
(2)
完成下列反应的化学方程式或离子方程式.
①H++SCN﹣+MnO2
 .
.②(CN)2和KOH溶液反应的化学方程式为
③已知阴离子的还原性强弱为:Cl﹣<Br﹣<CN﹣<SCN﹣<I﹣ . 试写出在NaBr和KSCN的混合溶液中加入(CN)2反应的离子方程式:
下列解释正确的是( )
A . H2O很稳定,是因为水分子之间存在氢键
B . HF的熔、沸点在同族元素的氢化物中出现反常,是因为HF分子中有氢键
C . 卤素单质从上到下熔沸点升高,是因为它们的组成结构相似,从上到下其摩尔质量增大,分子间的范德华力增大
D . 氨气极易溶于水,与氢键没有关系
下列关于F,Cl、Br、I相关物质性质的比较中,不正确的是( )
A . 单质的颜色随核电荷数的增加而加深
B . 单质的熔、沸点随核电荷数的增加而升高
C . 它们的氢化物的还原性随核电荷数的增加而增强
D . 它们的氢化物的稳定性随核电荷数的增加而增强
卤族元素的单质(F2、Cl2、Br2、I2)与H2反应过程中的能量变化如右图所示,其中a、b、c、d分别表示卤族中某一元素的单质,△E为相同物质的量的单质与H2反应过程中的能量变化(△E越大,表明反应越容易发生).请回答下列问题:

-
(1) d为,从d的水溶液中提取d的方法是.
-
(2) 红热的铜丝与b单质反应的现象为.
-
(3) a与H2反应的化学方程式为,b与H2反应的条件为.
-
(4) 由该能量变化示意图可得出的结论是同一主族,自上而下,元素的非金属性依次.
向含有NaBr、KI的混合溶液中通入过量的Cl2充分反应.将溶液蒸干,并灼烧所得的物质,最后剩余的固体物质是( )
A . NaCl和KI
B . NaCl、KCl和I2
C . KCl和NaBr
D . KCl和NaCl
卤素单质的性质与F2>Cl2>Br2>I2的变化规律不相符的是( )
A . 与氢气反应的剧烈程度
B . 气态氢化物的稳定性
C . 单质还原性的强弱
D . 与水反应的剧烈程度
关于卤素的下列叙述中正确的是( )
A . 卤素是典型的非金属元素,不能与其他非金属元素化合
B . 卤素单质越活泼,其溶沸点就越低
C . 卤素各单质都能和水剧烈反应
D . 卤素气态氢化物的稳定性越强,还原性也越强
根据元素周期律,卤族元素的下列性质从上到下依次递减的有( )
A . 非金属性
B . 原子半径
C . 单质的氧化性
D . 氢化物的稳定性
某炼金厂的废水因连降暴雨而溢出,导致河水严重污染,炼金废水中所含CN-有剧毒,其性质与卤素离子相似,还原性介于I-与Br-之间,HCN为弱酸.下列说法错误的是 ( )
A . CN-可以和稀硫酸反应生成HCN
B . CN-可被Cl2氧化成(CN)2
C . 在水溶液中(CN)2不能将F-氧化
D . HCN的电子式为 
砹是原子序数最大的卤族元素,根据卤素性质的递变规律,对砹及其化合物的叙述,正确的是( )
A . 与H2的化合能力:At2>I2
B . 砹在常温下为白色固体
C . 砹原子的最外电子层上有7个电子
D . 砹易溶于水,难溶于四氯化碳
卤族元素按F、Cl、Br、I的顺序,下列叙述正确的是( )
A . 单质的颜色逐渐加深
B . 气态氢化物的稳定性逐渐增强
C . 与氢气反应越来越容易
D . 单质的熔、沸点逐渐降低
运用元素周期律分析下面的推断,其中正确的是( )
A . 氢氧化铍[Be(OH)2]的碱性比氢氧化镁强
B . 砹(At)为有色固体,HAt不稳定
C . 单质钾与水反应不如钠与水反应更剧烈
D . 硒化氢(H2Se)是无色、有毒,比H2S稳定的气体
某溶液中含有的溶质是FeBr2、FeI2 , 若先向该溶液中通入一定量的氯气,再向反应后的溶液中滴加KSCN溶液,结果溶液变为红色  已知:AgBr、AgI分别为浅黄色和黄色不溶于硝酸的沉淀
已知:AgBr、AgI分别为浅黄色和黄色不溶于硝酸的沉淀  ,则下列叙述正确的是( )
,则下列叙述正确的是( )
 已知:AgBr、AgI分别为浅黄色和黄色不溶于硝酸的沉淀
已知:AgBr、AgI分别为浅黄色和黄色不溶于硝酸的沉淀  ,则下列叙述正确的是( )
,则下列叙述正确的是( )
A . 原溶液中的Br-一定被氧化
B . 通入氯气之后原溶液中的Fe2+一定被氧化
C . 溶液中一定不存在Fe2+
D . 若取少量所得溶液,再加入CCl4溶液,静置、分液,向上层溶液中加入足量的AgNO3 溶液,能产生黄色沉淀
在下列元素中,与氢气反应最剧烈的是( )
A . 氟
B . 氯
C . 溴
D . 碘
某化学小组用如图所示装置验证卤素单质氧化性的相对强弱。下列说法错误的是( )
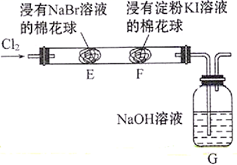
A . E处棉花球变成橙黄色,说明Cl2的氧化性比Br2强
B . F处棉花球变成蓝色,说明Br2的氧化性比I2强
C . E处发生反应的离子方程式为:Cl2+2Br-=2Cl-+Br2
D . G装置中NaOH溶液与Cl2反应的离子方程式为:Cl2+2OH-=Cl-+ClO-+H2O
四溴化钛(TiBr4)可用作橡胶工业中烯烃聚合反应的催化剂,常温下为橙黄色固体,熔点:38.3℃,沸点233.5℃,具有潮解性且易发生水解。实验室利用反应TiO2 +C+ 2Br2  TiBr4+CO2来制备TiBr4 , 装置如图所示。下列说法错误的是( )
TiBr4+CO2来制备TiBr4 , 装置如图所示。下列说法错误的是( )
 TiBr4+CO2来制备TiBr4 , 装置如图所示。下列说法错误的是( )
TiBr4+CO2来制备TiBr4 , 装置如图所示。下列说法错误的是( ) 
A . 开始反应时,活塞的状态为K1关闭,K2 , K3打开
B . 为防止连接管堵塞,反应过程中需微热连接管
C . 为达到实验目的,a应连接盛有NaOH溶液的洗气装置
D . 反应结束后继续通入CO2排出装置中残留的四溴化钛及溴蒸气
研究小组在探究卤素离子与硝酸银的反应时,进行了以下实验。
| 编号 | 操作 | 试剂 | 现象 |
| 1 | | ①KCl溶液②稀硝酸酸化的 | 产生白色沉淀 |
| 2 | ①KCl溶液②浓硝酸酸化的 | 产生白色沉淀 | |
| 3 | ①KI溶液 ②稀硝酸酸化的 | 产生黄色沉淀 | |
| 4 | ①KI溶液 ②浓硝酸酸化的 | 产生褐色的浊液 |
下列说法错误的是( )
A . 实验1和2说明,硝酸浓度不影响  的检验
B . 实验1和3说明,卤素离子的检验可使用稀硝酸酸化的
的检验
B . 实验1和3说明,卤素离子的检验可使用稀硝酸酸化的  溶液
C . 对比实验2和4,说明异常现象的产生与卤素离子种类有关
D . 由上述实验推测,
溶液
C . 对比实验2和4,说明异常现象的产生与卤素离子种类有关
D . 由上述实验推测, 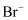 的检验不能使用浓硝酸酸化的
的检验不能使用浓硝酸酸化的  溶液
溶液
 的检验
B . 实验1和3说明,卤素离子的检验可使用稀硝酸酸化的
的检验
B . 实验1和3说明,卤素离子的检验可使用稀硝酸酸化的  溶液
C . 对比实验2和4,说明异常现象的产生与卤素离子种类有关
D . 由上述实验推测,
溶液
C . 对比实验2和4,说明异常现象的产生与卤素离子种类有关
D . 由上述实验推测, 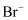 的检验不能使用浓硝酸酸化的
的检验不能使用浓硝酸酸化的  溶液
溶液
如图为元素周期表的一部分,请参照元素①②等在图中的位置,回答下列问题。
族 周期 | ⅠA | 0 | ||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | ||||||
3 | ⑤ | ⑥ | ⑦ | ⑨ | ||||
-
(1) 第三周期元素中非金属性最强的元素的原子结构示意图是。
-
(2) ⑥的最高价氧化物对应的水化物分别与⑤、⑨的最高价氧化物对应的水化物反应的离子方程式是、。
-
(3) 下列可以判断⑤和⑥金属性强弱的是(填序号)。
a.单质的熔点:⑤<⑥ b.化合价:⑤<⑥
c.单质与水反应的剧烈程度:⑤>⑥ d.最高价氧化物对应水化物的碱性:⑤>⑥
-
(4) ②③⑦的最高价氧化物均是(填“离子化合物”“共价化合物”)。
-
(5) 为验证第ⅦA族部分元素非金属性的递变规律,设计如图装置进行实验,请回答:

①仪器A的名称是,A中发生反应的离子方程式是。
②验证溴与碘的非金属性强弱:通入少量⑨的单质,充分反应后,将A中液体滴入试管内,取下试管,振荡、静置,可观察到。
③第ⅦA族元素非金属性随元素核电荷数的增加而逐渐减弱的原因:同主族元素从上到下,。
最近更新