卤素原子结构及其性质的比较 知识点题库
下列关于卤化氢的说法不正确的是( )
A . 卤素原子半径越大,氢化物越稳定
B . 卤素原子半径越大,氢化物越不稳定
C . 卤素氢化物稳定性:HF>HCl>HBr>HI
D . 卤族单质与氢气越难反应,生成的氢化物越不稳定
下列说法中,正确的是( )
A . 向KI溶液中通入适量Cl2后,溶液颜色变深
B . 向KCl溶液中滴加几滴酚酞试液,溶液颜色变红
C . 溴水与NaCl溶液混合时,会发生置换反应
D . NaCl溶液在空气中会被氧化,故需要密封保存
各组性质比较的表示中,正确的是( )
A . 还原性:HF<HCl<HBr<HI
B . 稳定性:HF<HCl<HBr<HI
C . 氧化性:F2<Cl2<Br2<I2
D . 沸点:Cl2<F2<Br2<I2
为了更好的掌握周期表的应用,某同学在做氯、溴、碘性质递变规律实验时,自己设计了一套实验方案,并记录了有关实验现象
实验步骤 | 实验现象 |
①将少量的氯水滴入到适量NaBr溶液中,再滴入少量的CCl4溶液并用力振荡 | A.溶液分为上下两层,上层为无色,下层为橙红色 |
②将少量的溴水滴入到适量KI溶液中,再滴入少量的CCl4溶液并用力振荡 | B.溶液分为上下两层,上层为无色,下层为紫红色 |
请你帮助该同学整理并完成实验报告.
-
(1) 实验目的:研究 元素性质递变规律
-
(2) 实验用品:试剂:氯水,溴水,NaBr溶液,KI溶液,CCl4溶液
玻璃仪器:① ②
-
(3) 此实验的结论为
-
(4) 氟、氯、溴、碘气态氢化物稳定性大小顺序(用分子式表示):
-
(5) 该同学又做了另外一个实验,向新制得的Na2S溶液中滴加新制的氯水.该实验现象为 .此反应的离子方程式 .此实验的结论为
表中的数据是破坏1mol物质中的化学键所消耗的能量(kJ).
物质 | Cl2 | Br2 | I2 | H2 | HF | HCl HBr HI |
能量 | 243 | 193 | 151 | 436 | 568 | 432 366 298 |
根据上述数据回答(1)~(5)题:
-
(1) 下列物质本身具有的能量最低的是 (填A.B.C.D)
A.H2 B.Cl2 C.Br2 D.I2
-
(2) 下列氢化物中,最稳定的是 (填A.B.C.D)
A.HF B.HCl C.HBr D.HI
-
(3) X2+H2=2HX(X代表Cl、Br、I)的反应是 反应(填“吸热”或“放热”)
-
(4) 相同条件下,X2(X代表Cl、Br、I)分别与氢气反应,当消耗等物质的量的氢气时,放出或吸收的热量最多的是 (填写分子式)
-
(5) 若无上表中的数据,你能正确回答出问题(4)吗? .(填能、否)你的根据是
元素周期表的用途广泛.
-
(1) 用“>”或“<”填空:
离子半径
非金属性
酸性
沸点
K+ S2﹣
N O
硫酸 高氯酸
HF HCl
-
(2) 能作为氯、溴、碘元素非金属性(原子得电子能力)递变规律的判断依据是 (填序号).
a.Cl2、Br2、I2的熔点 b.Cl2、Br2、I2的氧化性
c.HCl、HBr、HI的热稳定性 d.HCl、HBr、HI的酸性
-
(3)
工业上,通过如下转化可制得KClO3晶体:
NaCl溶液
 NaClO3溶液
NaClO3溶液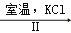 KClO3晶体
KClO3晶体①完成Ⅰ中反应的总化学方程式:□NaCl+□H2O═□NaClO3+□ .
②Ⅱ中转化的基本反应类型是 ,该反应过程能析出KClO3晶体而无其它晶体析出的原因是
-
(4)
一定条件,在水溶液中1mol Cl﹣、ClOx﹣(x=1,2,3,4)的能量(kJ)相对大小如图所示.
①D是 (填离子符号).
②B→A+C反应的热化学方程式为 (用离子符号表示)

下列有关第ⅦA族元素的单质和化合物性质说法正确的是( )
A . 还原性:HF>HCl>HBr>HI
B . 稳定性:HF<HCl<HBr<HI
C . 从F2到I2 , 颜色逐渐加深
D . 与氢气化合由易到难:I2>Br2>Cl2>F2
下列关于碱金属元素和卤素的说法中,错误的是( )
A . 溴单质与水的反应比氯单质与水的反应更剧烈
B . 碱金属元素中,锂原子失去最外层电子的能力最弱;卤素中,氟原子得电子的能力最强
C . 钾与水的反应比钠与水的反应更剧烈
D . 随核电荷数的增加,碱金属元素和卤素的原子半径都逐渐增大
下列元素属于卤族元素的是( )
A . F
B . P
C . He
D . Li
卤素单质及化合物在许多性质上都存在着递变规律.下列有关说法正确的是( )
A . 卤化银的颜色按AgCl、AgBr、AgI 的顺序依次加深
B . 卤化氢的键长按H﹣F、H﹣Cl、H﹣Br、H﹣I的顺序依次减小
C . 卤化氢的还原性按HF、HCl、HBr、HI的顺序依次减弱
D . 卤素单质与氢气化合按F2、Cl2、Br2、I2的顺序由难变易
溴化碘(IBr)的化学性质类似于卤素单质,试回答下列问题:
-
(1) 溴化碘的电子式是,它是由键形成的分子.
写出该反应的化学方程式.
-
(2) 溴化碘和水反应生成了一种三原子分子,该分子的电子式为,写出该反应的化学方程式.
氯元素的原子结构示意图为 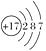 ,下列说法正确的是( )
,下列说法正确的是( )
A . 氯原子在化学反应中易失去电子
B . 氯原子易得到电子形成稳定的氯离子
C . 氯元素的化合价只有-1价
D . 氯的原子核外有7个电子
下列说法中,不符合ⅦA族元素性质特征的是( )
A . 从上到下元素的非金属性增强
B . 除F外其他元素最高价氧化物对应的水化物可表示为HXO4(X指卤族元素)
C . 单质的熔沸点逐渐升高
D . 单质都能与H2直接化合
随着卤素原子半径的增大,下列递变规律正确的是( )
A . 单质熔、沸点逐渐降低
B . 气态氢化物稳定性逐渐增强
C . 卤素X-离子的还原性逐渐增强
D . 单质的氧化性逐渐增强
类比法是化学学习过程中一种重要方法,以下类比关系正确的是( )
A . 加热条件下,钠与氧气反应生成过氧化钠,锂与氧气反应也生成过氧化锂
B . Cl2、Br2、I2都具有强氧化性,都能将铁氧化成+3价的铁盐
C . 铝与氧化铁能发生铝热反应,则铝与二氧化锰也能发生铝热反应
D . 氧化铁和氧化亚铁都是碱性氧化物,和硝酸反应都只生成盐和水
运用元素周期律分析下面的推断,其中不正确的是:( )
A . HBrO4的酸性比HIO4的酸性强
B . 砹(At)为有色固体,AgAt难溶于水也不溶于稀硝酸
C . 在氧气中,铷(Rb)的燃烧产物比钠的燃烧产物更复杂
D . 锂(Li)与水反应比钠与水反应剧烈
下列事实是由于氯的非金属性比硫强的结果的是( )
A . 次氯酸的酸性比硫酸弱
B . 氯能置换硫化氢中的硫
C . 硫离子的还原性比氯离子强
D . 硫能在空气中燃烧,而氯则不能
氰气的分子式为(CN)2 , 结构式为N≡C-C≡N,性质与卤素单质相似,下列叙述正确的是( )
A . 分子中既有极性键,又有非极性键
B . 分子中N≡C键的键长大于C-C键的键长
C . 该分子为极性分子
D . 该气体不能与氢氧化钠溶液反应
卤素是最活泼的一族非金属,下列关于卤族元素的说法正确的是( )
A . 卤素单质的最外层电子数都是7
B . 从上到下,卤素原子的电子层数依次增多,半径依次减小
C . 从F到I,原子核对最外层电子的吸引能力依次减弱,原子的得电子能力依次减弱
D . 卤素单质与H2化合由易到难顺序为F2<Cl2<Br2<I2
下列关于性质的比较,错误的是( )
A . 氧化性强弱:  B . 沸点高低:
B . 沸点高低:  C . 金属性强弱:
C . 金属性强弱:  D . 原子半径大小:
D . 原子半径大小: 
 B . 沸点高低:
B . 沸点高低:  C . 金属性强弱:
C . 金属性强弱:  D . 原子半径大小:
D . 原子半径大小: 
最近更新



