元素周期表的结构及其应用 知识点
元素周期表的结构:是指元素周期,元素的族分类,其结构特点是七个周期,16个族,每个纵列最外层电子数相同,每个周期电子层数相同。元素的分类中左边大部分是金属元素,右边是非金属元素。
其应用包括推测元素的结构,推测形成物质的性质,或者根据物质的性质找元素的位置,根据对角线规则判断元素及物质的性质。
其应用包括推测元素的结构,推测形成物质的性质,或者根据物质的性质找元素的位置,根据对角线规则判断元素及物质的性质。
元素周期表的结构及其应用 知识点题库
已知下列各种元素中A,B两元素的原子序数,其中可形成AB2型离子化合物的是( )
①6和8 ②12和17 ③20和9 ④11和17.
A . ①③
B . ①②
C . ②③
D . ③④
某元素的原子最外层有2个电子,关于该元素的推断一定正确的是( )
A . 是金属元素
B . 是IIA族元素
C . 是稀有气体元素
D . 无法确定
下列关于元素周期表的描述正确的是( )
A . 有7个周期,18个族
B . 第IA族元素也称为碱金属元素
C . 元素种类最多的族为第IIIB族
D . 第七周期若排满,最多可排50种元素
X、Y均为短周期元素,两者组成化合物的化学式为X2Y3 , 已知X的原子序数为m,则Y的原子序数不可能是( )
A . m+11
B . m+4
C . m﹣6
D . m﹣5
某同学对一些元素进行排列(表中数字为原子序数),根据现行的周期表,下列排列你认为合理的是( )
A .
B .
C .
D .
| 1 | 2 | 3 |
| 10 |
| 2 | 3 | 4 |
| 11 |
| 5 | 6 | 7 |
| 14 |
| 8 | 9 | 10 |
| 17 |
长式周期表共有18个纵行,从左到右排为1-18列,即碱金属为第一列,稀有气体元素为第18列。按这种规定,下列说法正确的是( )
A . 第9列元素中有非金属元素
B . 只有第二列的元素原子最外层电子排布为ns2
C . 第四周期第8列元素是铁元素
D . 第15列元素原子的最外层电子排布为ns2np5
短周期主族元素W、X、Y和Z的原子序数依次增大,W的气态氢化物的水溶液可使酚酞变红,W与X可形成一种红棕色有刺激性气味的气体,Y的原子半径是所有短周期主族元素中最大的,Z原子最外层电子数与W原子的电子总数相同。下列说法中正确的是()
A . W的氧化物对应水化物均为强酸
B . 简单离子半径:W<X<Y
C . 简单氢化物沸点:Z<W
D . Y与Z形成的化合物的水溶液呈碱性
X、Y、Z、M四种短周期元素,它们在周期表中位置如图所示,下列说法正确的是( )

A . 原子半径:M>Z>Y>X
B . Z的气态氢化物最稳定,因其分子间存在氢键
C . 最高价氧化物对应水化物的酸性M<Z
D . 元素的非金属性:X<Y<Z
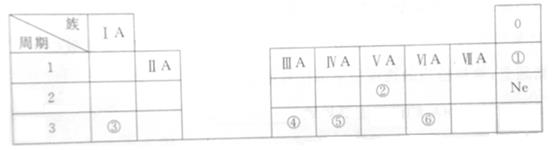
下表是元素周期表的一部分,表中的每个编号表示一种元素。请根据要求回答问题。
-
(1) ①的原子核外最外层电子数为。
-
(2) ③、⑥两种元素中,原子半径较小的是(填元素符号)。
-
(3) 气态氢化物的热稳定性⑤⑥(填“>“或”<“)。
-
(4) ②的最高价氧化物对应的水化物的化学式是。
某粒子的结构图是 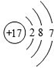 ,关于该粒子的说法错误的是( )
,关于该粒子的说法错误的是( )
 ,关于该粒子的说法错误的是( )
,关于该粒子的说法错误的是( )
A . 核外电子数为17
B . 其离子具有氖的电子层结构
C . 易得电子
D . 容易与金属原子形成化合物
下列说法正确的是( )
A . 最外层电子数大于4的一定是非金属元素
B . 元素周期表有18纵列,7横行,故有18个族,7个周期
C . 第ⅠA族就是碱金属
D . 某ⅡA族元素的原子序数为a,则和其同周期ⅢA的元素的原子序数可能为a+11
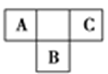
短周期元素A,B,C在元素周期表中的位置如图所示,已知A,B,C三种元素的原子核外电子数之和等于B的质子数的2倍。据此回答下列问题:
-
(1) A的气态氢化物的化学式为。
-
(2) B的元素符号为,在周期表中位于。
-
(3) C的单质的化学式为,其氢化物的水溶液可用于雕刻玻璃。
短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中Z所处的族序数是周期序数的2倍。下列判断正确的是( )
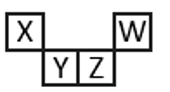
A . 最高正化合价:X<Y<Z<W
B . 原子半径:W<X<Y<Z
C . 气态氢化物的热稳定性:Z<W
D . 最高价氧化物对应水化物的酸性:Z<W
X、Y、Z、W、M均为短周期元素,M的一种核素不含中子,X、Y、Z、W在周期表中的位置如图所示,Y原子最外层电子数为内层电子数的3倍。下列说法错误的是( )
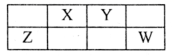
A . 原子半径:Z>X>Y>M
B . X、Y、Z、W与M均能形成18电子分子
C . X、Y、M形成的化合物水溶液一定呈酸性
D . Y的简单阴离子还原性弱于X的简单阴离子还原性
下列说法正确的是( )
A . N元素的电负性大于O元素
B . 基态Fe原子的外围电子排布图为 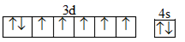 C . 在基态多电子原子中,P轨道电子能量一定高于s轨道电子能量
D . 根据原子核外电子排布的特点,Cu在周期表中属于s区元素
C . 在基态多电子原子中,P轨道电子能量一定高于s轨道电子能量
D . 根据原子核外电子排布的特点,Cu在周期表中属于s区元素
四种短周期主族元素X、Y、Z、W的原子序数依次增大。化合物甲由X、Y、Z三种元素组成。25℃时,0.01mol·L-1的甲溶液中  =1010;Z与W同周期,且W的最高化合价与最低化合价的代数和为4。下列说法错误的是( )
=1010;Z与W同周期,且W的最高化合价与最低化合价的代数和为4。下列说法错误的是( )
 =1010;Z与W同周期,且W的最高化合价与最低化合价的代数和为4。下列说法错误的是( )
=1010;Z与W同周期,且W的最高化合价与最低化合价的代数和为4。下列说法错误的是( )
A . 114号元素鈇(Fl)与Y在同一主族
B . 等物质的量的化合物Z2Y2与Z2W的阴离子个数相同
C . Y与X、Z均可形成具有漂白性的化合物
D . 最简单氢化物的稳定性:Y>W
如图是现行元素周期表的一部分,请回答:
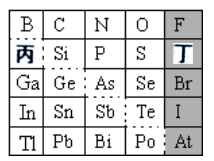
-
(1) 元素Se在周期表中的位置为。
-
(2) 下列说法正确的是___________。A . 丙位于周期表中从左到右数第13列 B . Bi的最高价氧化物的化学式为Bi2O5 C . 丁所形成的含氧酸是强酸 D . C,N,O三种元素的最高正价等于其所在族的族序数
-
(3) ①阴影部分元素所形成的氢化物中热稳定性最高的是(填化学式)。请从原子结构的角度解释其原因:。
②可在图中分界线(虚线部分)附近寻找(填序号)。
A.优良的催化剂 B.半导体材料 C.合金材料 D.新品种农药
-
(4) Pb能形成多种氧化物,如碱性氧化物PbO,酸性氧化物PbO2 , 还有类似于Fe3O4中铁元素价态特征(有两种价态)的Pb3O4 , Pb3O4能与硝酸发生非氧化还原反应生成一种盐和一种铅的氧化物,写出该反应的化学方程式。
下表是元素周期表的一部分,针对表中的①~⑨种元素,填写下列空白:
主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
二 | ① | ② | ③ | |||||
三 | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
-
(1) ①的元素名称是,⑥的元素符号是。
-
(2) ④的最高价氧化物的水化物中含有的化学键为。
-
(3) 上表所列元素中,最高价氧化物的水化物碱性最强的是(填化学式,下同),呈两性的氧化物是。②与③的简单氢化物中,热稳定性较强的是。
-
(4) ⑥的单质在空气中能燃烧,其燃烧产物属于化合物(填“共价”或“离子”),也可用Cu与浓硫酸在加热时制得该产物,其反应的化学方程式为。
下列有关元素周期表及其分区的理解错误的是( )
A . 元素周期表的每个周期中最后一种元素是稀有气体元素
B . 基态原子最外层电子排布为ns2的元素都位于周期表第IIA族
C . 主族元素处于元素周期表的s区和p区
D . 电负性最大的元素位于周期表的右上角(稀有气体除外)
A、B、C、D、E均为短周期主族元素,其原子序数依次增大。其中A元素原子核内只有一个质子;A与C、B与D分别同主族;B、D两元素原子序数之和是A、C两元素原子序数之和的2倍。请回答下列问题:
-
(1) 由上述元素组成的下列物质中属于非电解质的是____(填字母)。A .
 B .
B .  C .
C . 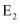 D .
D . 
-
(2) D元素在元素周期表中的位置为;写出A元素分别与B、D形成的18个电子的分子的化学式、。
-
(3) ①单质C在
 中反应的离子方程式是;
中反应的离子方程式是;②实验室制取
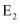 的化学方程式是。
的化学方程式是。
最近更新



