离子键的形成 知识点题库
下列物质中含离子键的是( )
A . Cl2
B . CO2
C . NaCl
D . CH4
下列物质中既有离子键又有共价键的可溶性化合物是( )
A . H2SO4
B . BaSO4
C . N2
D . NaOH
下列化合物中既有离子键又有共价键的是( )
A . KBr
B . N2
C . HBr
D . NaOH
在NH3和NH4Cl存在条件下,以活性炭为催化剂,用H2O2氧化CoCl2溶液来制备化工产品[Co(NH3)6]Cl3 , 下列表述正确的是( )
A . 中子数为32,质子数为27的钴原子:  B . H2O2的电子式:
B . H2O2的电子式:  C . NH3和NH4Cl化学键类型相同
D . [Co(NH3)6]Cl3中Co的化合价是+3
C . NH3和NH4Cl化学键类型相同
D . [Co(NH3)6]Cl3中Co的化合价是+3
 B . H2O2的电子式:
B . H2O2的电子式:
下列说法正确的是( )
A . NH4Cl晶体中只含离子键
B . CH4、SiH4、GeH4分子间作用力依次增大
C . 金刚石是原子晶体,加热融化时需克服分子间作用力与共价键
D . NH3和CO2两种分子中,每个原子的最外层都具有8电子稳定结构
有X、Y、Z、W、M五种短周期元素,其中X、Y、Z、W同周期,Z、M同主族;X+与M2-具有相同的电子层结构;离子半径:Z2->W-;Y的单质晶体熔点高、硬度大,是一种重要的半导体材料。请回答下列问题:
-
(1) Y元素的名称;
-
(2) W在元素周期表中的位置是第周期第族;
-
(3) X2M2中存在的化学键有、;
-
(4) Z、W氢化物的稳定性顺序为。(用化学式表示)
关于离子键、共价键的各种叙述中,下列说法中正确的是( )
A . 在离子化合物里,只存在离子键,没有共价键
B . 非极性键只存在于双原子的单质分子(如Cl2)中
C . 在共价化合物分子内,一定不存在离子键
D . 由不同元素组成的多原子分子里,一定只存在极性键
下列说法正确的是( )
A . 1molNa2O2晶体中阴离子与阳离子之比为1:1
B . 1molSi晶体中含4molSi—Si键
C . 60gSiO2中含Si—O键的个数为4NA
D . 12 g金刚石中含有C—C键的个数为NA
关于化学键的下列叙述中,错误的是( )
A . 离子化合物可能含共价键
B . 共价化合物一定含共价键
C . 离子化合物中只含离子键
D . 共价化合物中不含离子键
下列叙述正确的是( )
A . H216O、D216O、H218O、D218O互为同素异形体
B . 电解熔融状态的  可以制得
可以制得 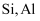 ,且都有氧气生成
C .
,且都有氧气生成
C . 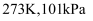 ,水分子间的平均距离
,水分子间的平均距离 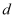 :
: 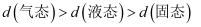 D . 海水中的
D . 海水中的  结晶成
结晶成  的过程,形成了化学键
的过程,形成了化学键
 可以制得
可以制得 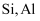 ,且都有氧气生成
C .
,且都有氧气生成
C . 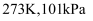 ,水分子间的平均距离
,水分子间的平均距离 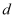 :
:  D . 海水中的
D . 海水中的  结晶成
结晶成  的过程,形成了化学键
的过程,形成了化学键
下列各组物质均既有离子键又有共价键的是( )
A . KOH、H2SO4、NH4Cl
B . CaO、Na2CO3、NH4HCO3
C . HClO、Al2O3、MgCl2
D . K2O2、NaOH、K2SO4
下列说法正确的是( )
A . 由分子构成的物质,均存在共价键
B . 相同条件下,H2O 比H2S 稳定是因为 H2O 分子中含有氢键
C . CH4 和 CCl4 中,每个原子的最外层都具有 8 电子稳定结构
D . 氯化钠是由钠离子和氯离子构成的离子化合物,加热熔化时需破坏离子键
下列物质中属于离子化合物的是( )
A . CH3 CH3
B . KOH
C . CO2
D . H2SO4
下表是元素周期表的一部分,请参照元素①-⑩在表中的位置,回答下列问题。
|
族 周期 |
IA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
|
2 |
① |
② |
③ |
④ |
||||
|
3 |
⑤ |
⑥ |
⑦ |
⑧ |
⑨ |
⑩ |
-
(1) ②的原子结构示意图是。
-
(2) 化学性质最不活泼的元素是(填元素符号)。
-
(3) 在③、④、⑤、⑥这些元素形成的最简单离子中,离子半径由大到小的顺序是。(填离子符号)。
-
(4) 在这些元素的最高价氧化物对应的水化物中,酸性最强的物质与碱性最强的物质在水溶液中发生的化学方程式为。
-
(5) 由元素③、⑤、⑨形成的一种常见的杀菌消毒剂中存在的化学键有。
-
(6) 由元素⑧和⑨形成的某种化合物可表示为X2Y2(其中各原子均满足8电子稳定结构),写出X2Y2的电子式:。
“中国紫”一硅酸铜钡(BaCuSi2O6),其合成原料为BaCO3、孔雀石[Cu2
(OH)2CO3]和砂子(SiO2)。回答下列问题:
-
(1) 基态Ba原子的价电子排布式为。
-
(2) SiO2常用作光导纤维,在生产和生活中有广泛的用途。在SiO2晶体中,硅原子的杂化类型为。
-
(3) Cu2(OH)2CO3不溶于水,但可溶于浓氨水,反应的化学方程式为Cu2(OH)2CO3+8NH3·H2O=[Cu(NH3)4]CO3 +[Cu(NH3)4](OH)2 +8H2O
①氨水中存在的化学键有 (填标号)。
A.极性键 B.非极性键 C.氢键 D.σ键 E.π键
②[Cu(NH3)4]CO3中配体是 ,所含元素中电负性最小的非金属元素是(填元素符号)。
-
(4) Cu2O的熔点比Cu2S的 (填“高”或“低”),原因是。
-
(5) Cu和Ba形成的某种合金的晶胞结构如图所示,该晶体中Cu与Ba的原子个数比为。

W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图。已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的非金属性在同周期元素中最强。下列说法错误的是( )

A . 对应简单离子半径:X<W
B . 对应简单气态氢化物的稳定性:Y<Z
C . 化合物XZW既含离子键也含共价键
D . Y、Z最高价氧化物对应水化物的酸性:Y>Z
下列说法错误的是( )
A . CaCl2中既有离子键又有共价键,所以CaCl2属于离子化合物
B . H2O分解为H2和O2 , 既有共价键的破坏又有共价键的形成
C . C5H12有多种同分异构体,因为分子间作用力大小不同,因而沸点不同
D . 按F、Cl、Br、I顺序元素非金属性逐渐减弱是因为它们的原子半径逐渐增大
X、Y、Z、W是原子序数依次增大的四种短周期元素,其中X、W同主族,X原子的最外层电子数是次外层的3倍,Y的最高价氧化物对应水化物的碱性在短周期中最强,Z单质是人类将太阳能转变为电能的常用材料。下列说法正确的是( )
A . 原子半径:X<Y<Z<W
B . X 与Y形成的化合物中只含离子键
C . 简单氢化物的热稳定性:W>Z
D . ZX2能与碱反应,但不能与任何酸反应
下列说法不正确的是( )
A . 金属键的本质是金属阳离子与自由电子间的相互作用
B . H2O的热稳定性大于H2S,这与H2O分子间易形成氢键无关
C .  的沸点高于
的沸点高于 是因为其范德华力更大
D . 离子键无方向性和饱和性,而共价键有方向性和饱和性
是因为其范德华力更大
D . 离子键无方向性和饱和性,而共价键有方向性和饱和性
 的沸点高于
的沸点高于 是因为其范德华力更大
D . 离子键无方向性和饱和性,而共价键有方向性和饱和性
是因为其范德华力更大
D . 离子键无方向性和饱和性,而共价键有方向性和饱和性
下列物质中,含离子键的是( )
A . CO2
B . KCl
C . H2O
D . Cl2
最近更新



