卤素原子结构及其性质的比较 知识点题库
下列关于卤族元素的比较中,错误的是
A . 气态氢化物的稳定性:HF>HCl>HBr>HI
B . 单质的氧化性:F2>Cl2>Br2>I2
C . 离子的还原性:F->Cl->Br->I-
D . 元素的非金属性:F>Cl>Br>I
F、Cl和Br都是 VIIA族元素,关于这三种元素原子的说法正确的是( )
A . 原子半径:F>Cl>Br
B . 最外层电子数都相同
C . 核外电子层数都相同
D . 最外层电子数依次增多
A、B、C、D为按顺序排列的前四种卤素单质,仔细分析下表中的数据,回答有关问题.
卤素单质 | 密度(标准状况下) | 沸点/℃ | 熔点/℃ | 溶解度(标准状况下,100g水中) |
A | 1.696 g•l﹣1 | ﹣188.1 | ﹣219.6 | ﹣﹣ |
B | 3.214 g•l﹣1 | ﹣34.6 | ﹣101 | 226 cm3 |
C | 3.119 g•cm﹣3 | 58.78 | ﹣7.2 | 4.16 g |
D | 4.93 g•cm﹣3 | 184.4 | 113.5 | 0.029 g |
-
(1) 在标准状况下为液体的卤素单质是 (填字母,下同),为固体的卤素单质是
-
(2) A的相对分子质量为 (保留整数)
-
(3) 写出B与水反应的化学方程式
-
(4) 卤素单质B、C、D的氧化性由大到小的顺序为 (用化学式表示)
-
(5)
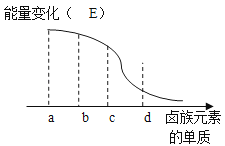
卤族元素的单质与H2反应过程中的能量变化如图所示,其中a、b、c、d分别表示卤族中某一元素的单质,E为相同物质的量的单质与H2反应过程中的能量变化(△E越大,表明反应越容易发生).请回答下列问题:d为 (写化学式,下同),红热的铜丝在b单质中燃烧的现象为
下列关于F,Cl、Br、I性质的比较,不正确的是( )
A . 它们的原子核外电子层数随核电核数的增加而增多
B . 被其它卤素单质从其卤化物中置换出来的可能性随核电核数的增加而增大
C . 它们的氢化物的稳定性随核电核数的增加而增强
D . 单质的颜色随核电核数的增加而加深
类比推理是化学中常用的思维方法.下列推理正确的是( )
A . Fe与Cl2反应生成FeCl3 , 推测Fe与I2反应生成FeI3
B . CO2与Ba(NO3)2溶液不反应,SO2与Ba(NO3)2溶液也不反应
C . CO2是直线型分子,推测CS2也是直线型分子
D . NaCl与浓H2SO4加热可制HCl,推测NaBr与浓H2SO4加热可制HBr
有以下说法:①氯原子和氯离子性质一样 ②+7价的氯只具有氧化性 ③氯原子比氯离子多一个电子 ④氯气具有氧化性,不具有还原性 ⑤氯原子比氯离子半径小 ⑥高氯酸是最高价含氧酸中酸性最强的,其中说法正确的是( )
A . ③⑤⑥
B . ①②③
C . ②⑤⑥
D . ④⑤⑥
随着卤素原子半径的增大,下列递变规律正确的是( )
A . 单质熔、沸点逐渐降低
B . 气态氢化物稳定性逐渐增强
C . 卤素离子的还原性逐渐增强
D . 元素的非金属性逐渐增强
下列关于卤素的说法正确的是( )
A . Cl2具有很强的氧化性,在化学反应中只能作氧化剂
B . 氧化性Cl2>Br2>I2还原性Cl﹣>Br﹣>I﹣
C . 实验室制备Cl2 , 可用排饱和食盐水集气法收集
D . 氯水具有酸性,能使紫色石蕊试剂先变红后褪色,也可用pH试纸测量其pH值
不能作为氯、溴、碘元素非金属性(原子得电子能力)递变规律的判断依据是( )
A . HCl、HBr、HI的热稳定性
B . Cl2、Br2、I2的氧化性
C . Cl2、Br2、I2的熔点
D . HCl、HBr、HI的还原性
下列有关卤素单质及其化合物的说法正确的是( )
A . 卤素单质与氢气化合按F2、Cl2、Br2、I2的顺序由难变易
B . 卤化氢的稳定性按HF、HCl、HBr、HI的顺序依次增大
C . 卤化氢的还原性按HF、HCl、HBr、HI的顺序依次减弱
D . 卤化银的颜色按AgCl、AgBr、AgI的顺序依次加深
下列关于卤素的叙述,正确的是( )
A . 随核电荷数的增加 X﹣的半径递增,还原性递减(用X表示卤素原子)
B . 氢化物的稳定性随核电荷数的增加逐渐增强
C . 单质与水反应均可表示为 X2+H2O═HX+HXO(用X表示卤素原子)
D . 单质的颜色随核电荷数的增加逐渐加深
下列相关示意图正确的是( )
A | B | C | D |
将氨水滴到氯化铝溶液中至过量 | 将二氧化碳逐渐通入氯水中至过量 | 将铜粉加入到浓硝酸中至过量 | 卤族元素的氧化物沸点随核电荷数的变化 |
| | | |
A . A
B . B
C . C
D . D
在4份碘化钾淀粉溶液中,分别加入下列物质,不能使溶液变蓝的是( )
A . 氯化氯
B . 溴水
C . 氯气
D . 碘的酒精溶液
下列元素属于卤族元素的是( )
A . He
B . P
C . Li
D . F
下列叙述中正确的是( )
A . 卤素单质与水反应均可用X2+H2O=HXO+HX表示
B . 从F2到I2 , 卤素单质的颜色随着相对分子质量的增大而加深
C . 熔、沸点:Li>Na>K
D . 还原性:K>Na>Li,故K可以从NaCl溶液中置换出金属钠
砹(At)原子序数85,与F、Cl、Br、I同族,推测砹或砹的化合物不可能具有的性质是( )
A . 砹是有色固体
B . 非金属性:At>I
C . HAt非常不稳定
D . I2 可以从At的可溶性的盐溶液置换出来
下列情况下,不能用来比较卤族元素非金属性强弱的是( )
A . 气态氢化物的稳定性
B . 气态氢化物水溶液的酸性
C . 单质之间的置换反应
D . 最高价氧化物对应水化物酸性的强弱
下列说法中,不符合ⅦA族元素性质特征的是( )
A . 易形成-1价离子
B . 从上到下原子半径逐渐减小
C . 从上到下单质的氧化性逐渐减弱
D . 从上到下氢化物的稳定性依次减弱
1869年,俄国化学家门捷列夫制作出了第一张元素周期表,揭示了化学元素间的内在联系,成为化学发展史上的重要里程碑之一、下表列出了①~⑦7种元素在周期表中的位置。
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
2 | ① | ② | |||||
3 | ③ | ④ | ⑤ | ⑥ | |||
4 | ⑦ |
请回答下列问题:
-
(1) ⑤的简单阴离子结构示意图为。
-
(2) ⑥的单质与⑦的简单阴离子反应的离子方程式为。
-
(3) ④的氧化物与③的氢氧化物反应的化学方程式为。
-
(4) ①、②分别与氢元素组成含10个电子的阳离子的化学式分别为、。
-
(5) 铷被誉为“长眼睛”的金属,是本世纪最具潜力的光电材料,是因为铷最突出的特点在于它的原子核外电子很不稳定,可见光的能量足以使其原子电离。已知铷是37号元素,相对原子质量是85。
i.铷在元素周期表中的位置:第周期、第族。
ii.关于铷的下列说法中错误的是(填字母序号)。
a.与水反应比钠更剧烈 b.熔沸点高于钠 c.原子半径大于钾 d.金属性弱于钾
已知卤素互化物的性质与卤素单质类似,下列关于BrCl的说法不正确的是( )
A . BrCl有强氧化性
B . BrCl能与KI发生氧化还原反应
C . BrCl是共价化合物
D . BrCl能与NaOH溶液反应生成NaClO、NaBr和H2O
最近更新