碱金属及其化合物的性质实验 知识点题库
已知X为一种常见酸的浓溶液,能使蔗糖粉末变黑.A与X反应的转化关系如图所示,其中反应条件及部分产物均已略去,则下列有关说法正确的是( )
(1)钾的原子核外有19个电子,画出钾的原子结构示意图 .
(2)预测钾的化学性质,完成下列反应的化学方程式.
①点燃钾剧烈燃烧 ;
②将小块钾投入冷水中 .
(3)推测钾在自然界中的存在方式是 (填“游离态”或“化合态”).
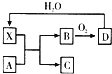
超氧化钾(KO2)又称为化学氧自救剂,容易与空气中的水、二氧化碳等发生反应,主要用于煤矿井下急救.某兴趣小组拟选用如下装置制备超氧化钾(部分夹持仪器已略去).
请回答下列问题:
-
(1) 请选择必要的装置,按气流方向的连接顺序为 (填仪器接口的字母).
-
(2) 请根据完整的实验装置,完成下列实验步骤:① ;②装入药品,打开分液漏斗活塞;③持续通入气体一段时间后,点燃酒精灯进行反应;④反应结束后,熄灭酒精灯,待反应管冷却至室温,停止通入氧气,并关闭分液漏斗的活塞;⑤拆除装置,取出产物.
-
(3) 数据记录如下:
空陶瓷管的质量
陶瓷管与钾的总质量
陶瓷管与产物的总质量
14.80g
15.19g
15.47g
根据数据计算可得实验式KOx , 则x= .
-
(4) 超氧化钾可吸收二氧化碳,并生成氧气,因此可以作为飞船、潜艇等密闭系统的氧气再生剂.写出超氧化钾与二氧化碳反应的化学方程式: .与过氧化钠相比,其优点是 .
如图所示装置,试管中盛有水,气球a盛有干燥的固体过氧化钠颗粒,U形管中注有浅红色的水,已知过氧化钠与水反应是放热的.将气球用橡皮筋紧缚在试管口,实验时将气球中的固体颗粒抖落到试管b的水中,将观察到的现象是( )
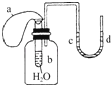
在高一化学教材中,介绍了过氧化钠与二氧化碳及水的反应:
2Na2O2+2CO2═2Na2CO3+O2 2Na2O2+2H2O=4NaOH+O2↑
然而,过氧化钠与其他非金属氧化物(如:NO、NO2等)的反应能否发生呢?为此,某校化学兴趣小组设计了以下实验进行探究:
步骤一:NO、NO2的制备
①本实验所用的NO由饱和硫酸亚铁溶液与浓硫酸和粉末状硝酸钾反应制备,在酸性环境中硝酸根离子被还原为NO,得到的NO的纯度约为98%;
反应的化学方程式为:
②NO2由硝酸铅受热分解得到:2Pb(NO3)2=2PbO+4NO2↑+O2↑使生成的气体通过 (从以下选项中选择最佳方案)可以使NO2得以净化.
A.装有H2O的洗气瓶 B.置于冰水中的U形管(NO2沸点21℃)
C.装有浓硫酸的洗气瓶 D.装有Na2SO3溶液的洗气瓶
步骤二:操作(如图,b、c为弹簧夹)
①先打开b关闭c,通入 (从所给选项选出)5分钟;目的是
A.空气 B.O2C.CO2 D.N2
②然后 ,再分别从a处通入NO或NO22分钟.
现象:当通入NO时,B中靠近A侧浅黄色固体变成黄色,气囊未见鼓起;当通入NO2时,B中靠近A侧浅黄色固体变成白色,气囊也未见鼓起;
步骤三:产物检验
分别取出B中黄色固体或白色固体进行检验,得知两种固体均为盐.
结论:
请写出NO2与 Na2O2反应的化学方程式: .
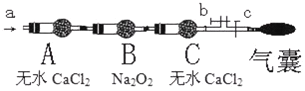
某化学兴趣小组的学生从网上查得如下信息:①钠能在CO2中燃烧.②常温下CO能与PdCl2溶液反应得到黑色的Pd.经过分析讨论,他们认为钠在CO2中燃烧时,还原产物可能是碳、也可能是CO;氧化产物可能是Na2CO3 , 为验证上述推断,他们设计如下方案进行实验,请回答下列问题:
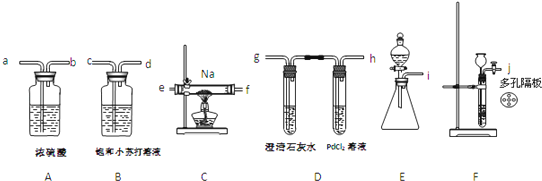
(1)他们欲用上述仪器组装一套装置:用石灰石与盐酸反应制取CO2(能随意控制反应的进行)来证明钠能在CO2中燃烧、检验气态还原产物,所用仪器接口连接顺序为 ,制取CO2反应的离子方程式为
(2)装置连接好后,首先要进行的实验操作是 ;点燃酒精灯前,应进行的操作是 ;等装置 现象时,再点酒精灯,这步操作的目的是 .
(3)若仪器D中有黑色沉淀,C中残留固体(只有一种物质),则C中反应的化学方程式为 ;若仪器D中溶液无黑色沉淀,C中残留固体(有两种物质),则C中反应的化学方程式为 .
某课外学习小组在学习了Na2O2与CO2的反应后,认为Na2O2与SO2应该也可以反应.他们设计了下图装置(夹持装置已略去,装置的气密性良好)进行实验,探究SO2与Na2O2反应的产物,请按要求回答下列问题.
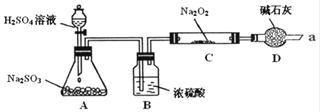
写出装置A中发生反应的化学方程式: .
装置D的作用:除了可以防止空气中的CO2、水蒸气等进入C中与Na2O2反应,还可以 在通入足量的SO2与Na2O2充分反应后,他们对C中固体产物提出如下假设:
假设1:只有Na2SO3;假设2: ;假设3:既有Na2SO3 , 又有Na2SO4 .
(1)若假设1成立,写出SO2与Na2O2反应的化学方程式: .
(2)为进一步确定C中反应后固体产物的成分(Na2O2已反应完全),甲同学设计了如下实验:

甲同学由此得出结论:产物是Na2SO4 , 该方案是否合理 (填“是”或“否”),理由是
(3)乙同学设计了如下实验验证假设3成立,请帮助他完成下表.
实验步骤 | 现象 |
①取少量C中固体产物于试管中,加入适量的蒸馏水溶解. | 固体全部溶解 |
②向上试管中加入过量的 , 将产生的气体通入少量酸性KMnO4溶液中. | KMnO4溶液 |
③向步骤②反应后的试管中,加入适量的BaCl2溶液. | 产生白色沉淀 |
步骤②中将产生的气体通入少量酸性KMnO4溶液中,发生反应的离子方程式为: .
①都是银白色的柔软金属(除铯外),密度都比较小
②单质在空气中燃烧生成的都是过氧化物
③碱金属单质都与水剧烈反应
④单质的熔、沸点随着原子序数的增加而升高
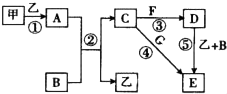
请回答下列问题:
-
(1) A是.
-
(2) 反应①~⑤中,属于氧化还原反应的是填序号).
-
(3) 反应⑤的化学方程式为;甲与B反应的离子方程式为.
-
(4) 在空气中将C溶液滴入F溶液中,观察到的现象是.
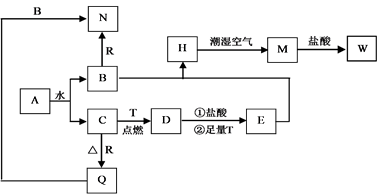
-
(1) 写出下列物质的化学式
ADR
-
(2) 按要求写下列反应方程式
H在潮湿空气中变成M的化学方程式
D与盐酸反应的离子方程式
-
(1) 从X、Y、Z、W四种元素中选择合适的元素,组成与表中第一栏类别相同的物质,将其化学式填在表中相应的空格内。
类型
碱性氧化物
最高价的酸性氧化物
二元强酸
可溶性碱
弱酸的酸式盐
化学式
-
(2) 选用你在上表中所填的物质,按下列要求写出相应的化学方程式。
①某个化合反应:
②氧化物与足量的碱反应:
③酸式盐和足量的碱反应:
[提示:酸碱中和反应生成和水,酸跟碱反应时,若酸、碱电离产生的氢离子和氢氧根离子恰好完全反应,生成的为正盐(如NaCl、 Na2CO3);若酸中的氢离子部分被中和,生成的盐为酸式盐(如 NaHCO3)。一元酸没有酸式盐]
-
(1) 用如图装置制备纯净的CO2
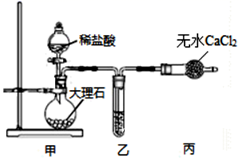
①甲装置中盛放稀盐酸的仪器名称是。
②丙装置的作用是。
-
(2) 按照下图进行实验(夹持装置略)。
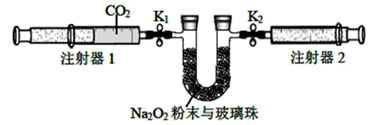
①先组装仪器,然后,再用注射器1抽取100 mL纯净的CO2 , 将其连接在K1处,注射器2的活塞推到底后连接在K2处,具支U形管中装入足量的Na2O2粉末与玻璃珠。
②打开止水夹K1、K2 , 向右推动注射器1的活塞,可观察到的现象是。
③实验过程中,需缓慢推入CO2 , 其目的是,反应的化学方程式。
-
(3) 实验结束后,当注射器1的活塞推到底时,测得注射器2中气体体积为65 mL,则反应消耗CO2的体积是。
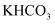 受热易分解产生
受热易分解产生  C . 金属钾燃烧时生成氧化钾
D . 金属钾可保存在煤油中
C . 金属钾燃烧时生成氧化钾
D . 金属钾可保存在煤油中



