溶液的组成及性质 知识点题库
下列各项比较中,正确的是( )
A . 含碳量:生铁>钢
B . 熔点:铁<汞
C . 氢氧化钙的溶解度:80℃>20℃
D . 核外电子数:钠原子<钠离子
下列关于0.1mol•L﹣1Ba(NO3)2溶液的正确说法是( )
A . 该溶液可由1L水中溶解0.1molBa(NO3)2制得
B . 1L该溶液中含有Ba2+和NO3﹣离子总数为3×6.02×1022 个
C . 0.5L该溶液中Ba2+离子的物质的量浓度为0.2 mol•L﹣1
D . 0.5L该溶液中NO3﹣离子的物质的量浓度为0.1 mol•L﹣1
以下分散系,属于溶液的是( )
A . 少量NaCl与水充分混合
B . 泥沙与水充分混合
C . 在沸水中滴加饱和FeCl3溶液
D . CCl4与水混合
在物质混合、反应等过程中,会存在“1+1≠2”的现象.通常情况下,下列各种混合或反应过程中,“1+1”不等于“2”的是( )
A . 1g酒精和1g水混合后的总质量
B . 1mL酒精与1mL水混合均匀后所得溶液的总体积
C . 温度一定时1g饱和硝酸钾溶液中加入1g硝酸钾后,所得溶液的质量
D . 1g氢氧化钠溶液和1g醋酸溶液中和后溶液的总质量
以下关于“水”的说法中,正确的是( )
A . 澄清透明的水,就是纯净的水
B . 天然雨水是纯净物
C . 饮用反复煮沸的天然水有利于健康
D . 蒸馏水中不含有Ca2+、Mg2+等金属离子
下列图示与对应的叙述不相符的是( )
A .  如图表示KNO3的溶解度曲线,图中a点所示的溶液是80℃时KNO3的不饱和溶液
B .
如图表示KNO3的溶解度曲线,图中a点所示的溶液是80℃时KNO3的不饱和溶液
B .  如图表示某放热反应分别在有、无催化剂的情况下反应过程中的能量变化
C .
如图表示某放热反应分别在有、无催化剂的情况下反应过程中的能量变化
C .  如图表示0.1000mol•L﹣1 NaOH溶液滴定20.00mL 0.1000mol•L﹣1醋酸溶液得到的滴定曲线
D .
如图表示0.1000mol•L﹣1 NaOH溶液滴定20.00mL 0.1000mol•L﹣1醋酸溶液得到的滴定曲线
D .  如图表示已达平衡的某反应,在t0时改变某一条件后反应速率随时间变化,则改变的条件可能是增大压强
如图表示已达平衡的某反应,在t0时改变某一条件后反应速率随时间变化,则改变的条件可能是增大压强
 如图表示KNO3的溶解度曲线,图中a点所示的溶液是80℃时KNO3的不饱和溶液
B .
如图表示KNO3的溶解度曲线,图中a点所示的溶液是80℃时KNO3的不饱和溶液
B .  如图表示某放热反应分别在有、无催化剂的情况下反应过程中的能量变化
C .
如图表示某放热反应分别在有、无催化剂的情况下反应过程中的能量变化
C .  如图表示0.1000mol•L﹣1 NaOH溶液滴定20.00mL 0.1000mol•L﹣1醋酸溶液得到的滴定曲线
D .
如图表示0.1000mol•L﹣1 NaOH溶液滴定20.00mL 0.1000mol•L﹣1醋酸溶液得到的滴定曲线
D .  如图表示已达平衡的某反应,在t0时改变某一条件后反应速率随时间变化,则改变的条件可能是增大压强
如图表示已达平衡的某反应,在t0时改变某一条件后反应速率随时间变化,则改变的条件可能是增大压强
(1)同温、同压下等质量的SO3和NO2 , 它们所占的体积比为 ,所含氧元素的物质的量之比为 .
(2)2mol O2与1mol O3的摩尔质量的比是 .
(3)某化合物的相对分子质量为m,在t℃时A ml该化合物的饱和溶液为B g,将其蒸干后得到固体C g.该化合物在t℃时的溶解度为 g,该饱和溶液中溶质的物质的量浓度为 mol/L.
(4)实验室制取氯气的化学方程式为:4HCl(浓)+MnO2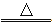 Cl2↑+MnCl2+2H2O,
Cl2↑+MnCl2+2H2O,
请回答:MnO2与被氧化的HCl的物质的量之比是 ;用单线桥法标出电子转移的方向和数目:
20℃时,饱和KCl溶液的密度为1.174g•cm﹣3 , 物质的量浓度为4.0mol•L﹣1 , 则下列说法中不正确的是( )
A . 20℃时,饱和KCl溶液与等质量的水混合后物质的量浓度大于2.0mol•L﹣1
B . 20℃时,将29.8 gKCl溶于87.6g水中可得饱和溶液
C . 20℃时,密度小于1.174g•cm﹣3的KCl溶液是不饱和溶液
D . 将此溶液蒸发部分水,再恢复到20℃时,溶液中各离子的浓度不变
如图是甲、乙两种物质的溶解度曲线,下列说法正确的是( )

A . 甲的溶解度大于乙的溶解度
B . t1℃时,甲的溶解度为ag
C . 升高温度,乙的饱和溶液全变成不饱和溶液
D . t2℃时,分别将甲、乙两种物质的饱和溶液降温到t1℃,所得溶液的溶质质量分数相等
将40℃时的饱和KCl溶液冷却至10℃,该过程中保持不变的是( )
A . KCl的溶解度
B . 溶剂的质量
C . 溶质的质量分数
D . 溶液中K+的数目
溶解度为S克的某物质的饱和溶液,跟水以1 : 4的质量比混合后,溶液的质量百分比浓度为( )
A .  ×100%
B .
×100%
B .  ×100%
C .
×100%
C .  %
D .
%
D .  %
%
 ×100%
B .
×100%
B .  ×100%
C .
×100%
C .  %
D .
%
D .  %
%
如图是甲、乙、丙三种不同物质(不含结晶水)的溶解度曲线图。下列有关叙述正确的是( )

A . t1℃时,分别取出相同质量的甲、丙两种饱和溶液升温到t2℃时,甲和乙溶质的质量分数相等
B . t2℃时,将甲、乙两种饱和溶液分别恒温蒸发等质量的水,析出晶体的质量可能不等
C . 将三种饱和溶液分别从t3℃降低到t2℃时,甲和乙溶质的质量分数减小,丙的溶质的质量分数不变
D . 当甲的饱和溶液中含有少量乙时,可以采取冷却热饱和溶液的办法提取乙
根据溶解度曲线,在80 ℃时将含有等物质的量的硝酸钠和氯化钾混合溶液恒温蒸发,首先析出的是( )

A . 氯化钾
B . 硝酸钠
C . 氯化钠
D . 硝酸钾
25 ℃时,某溶液中只含有Na+、H+、OH-、A-四种离子。下列说法正确的是( )
A . 对于该溶液一定存在:pH≥7
B . 在c(OH-)>c(H+)的溶液中不可能存在:c(Na+)>c(OH-)>c(A-)>c(H+)
C . 若溶液中c(A-)=c(Na+),则溶液一定呈中性
D . 若溶质为NaA,则溶液中一定存在: c(Na+)>c(A-)>c(OH-)>c(H+)
既能与酸(H+)反应,又能与碱(OH-)反应的化合物是 ( )
①MgO ②Al(OH)3 ③NaHSO4 ④NaHCO3 ⑤CH3COONH4 ⑥Al
A . ②④
B . ②③④
C . ②④⑤
D . ②④⑥
Fe(OH)3胶体和MgCl2溶液的本质区别是( )
A . Fe(OH)3胶体有颜色,MgCl2溶液无色
B . MgCl2溶液均一、稳定,Fe(OH)3胶体不稳定
C . MgCl2溶液中分散质粒子的直径小于1 nm,Fe(OH)3胶体中分散质粒子的直径为1~100 nm
D . Fe(OH)3胶体有丁达尔效应,MgCl2溶液没有丁达尔效应
将  的饱和石灰水冷却至
的饱和石灰水冷却至  ;或加入少量
;或加入少量 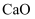 但温度仍保持
但温度仍保持  ,在这两种情况下均未改变的是( )
,在这两种情况下均未改变的是( )
 的饱和石灰水冷却至
的饱和石灰水冷却至  ;或加入少量
;或加入少量 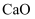 但温度仍保持
但温度仍保持  ,在这两种情况下均未改变的是( )
,在这两种情况下均未改变的是( )
A . 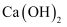 的溶解度、溶剂的质量
B . 溶液中溶质的质量分数
C . 溶液的质量、水的电离平衡
D . 溶液中
的溶解度、溶剂的质量
B . 溶液中溶质的质量分数
C . 溶液的质量、水的电离平衡
D . 溶液中 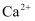 的数目、
的数目、 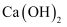 的溶解平衡
的溶解平衡
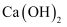 的溶解度、溶剂的质量
B . 溶液中溶质的质量分数
C . 溶液的质量、水的电离平衡
D . 溶液中
的溶解度、溶剂的质量
B . 溶液中溶质的质量分数
C . 溶液的质量、水的电离平衡
D . 溶液中 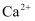 的数目、
的数目、 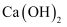 的溶解平衡
的溶解平衡
影响KCl在水中的溶解度的因素是( )
A . 水的温度
B . 搅拌的速率
C . 水的体积
D . KCl颗粒的大小
常温下,向20 mL0.01 mol·L-1的NaOH溶液中逐滴加人0.01 mol·L-1的CH3COOH溶液,溶液中由水电离出的c水(OH-)的对数随加人CH3COOH溶液体积的变化如图所示,下列说法正确的是( )

A . H、F点溶液显中性
B . E点溶液中由水电离的c水(OH-)=1×10-3 mol·L-1
C . H点溶液中离子浓度关系为c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
D . G点溶液中各离子浓度关系为c(CH3COO-)=c(Na+)+c(H+)-c(OH-)
下列有关溶液和胶体的性质说法中正确的是( )
A . 溶液和胶体都是无色透明的液体
B . 向氢氧化铁胶体中加入过量的稀硫酸溶液,最终现象是产生红褐色沉淀
C . 汽车远程灯照在前方有扬尘的空气中,会有一条光亮的“通路”,说明这份混有扬尘的空气具有胶体的性质
D . 溶液、胶体本质的区别是是否产生丁达尔效应
最近更新



