溶液的组成及性质 知识点题库
根据下图溶解度曲线,在恒定70℃将物质的量浓度相等的硝酸钠溶液和氯化钾溶液等体积混合降温至25℃,首先析出的是( )
A . 氯化钠
B . 硝酸钠
C . 氯化钾
D . 硝酸钾
中学化学课本中有大量的数据材料,下列各项对数据的应用中正确的是( )
A . 利用溶解度数据判断水垢的主要成分是CaCO3和Mg(OH)2 , 而不是CaCO3和MgCO3
B . 利用键能数据判断晶体的熔点高低
C . 根据相对原子质量判断元素的原子序数
D . 根据反应热的大小判断反应进行速率的快慢
下列说法正确的是( )
A . 所有放热反应均是自发反应,也是熵增大的反应
B . 向AgCl固液混合物中滴入KI饱和溶液,有AgI沉淀生成,说明AgCl的溶解度小于有AgI的溶解度
C . 锌与稀硫酸反应制取氢气,加入少量的硫酸铜粉末会使产生氢气的速度减慢
D . 在海轮外壳连接锌块保护外壳不受腐蚀是采用了牺牲阳极的阴极保护法
反应:NaCl+CO2+NH3+H2O=NaHCO3↓+NH4Cl是“氨碱法”的重要反应,以下是对该反应涉及的有关知识的部分见解,其中不正确的是( )
A . 该条件下NaHCO3的溶解度较小
B . NaHCO3不是纯碱
C . 析出固体后的溶液为NaHCO3的不饱和溶液
D . 析出晶体后的溶液为NaHCO3的饱和溶液
工业上将相同物质的量的NaCl、CO2、NH3在30℃时配成溶液,此时溶液中无晶体。当降温至某温度时,开始析出晶体,此晶体是( )

A . NH4Cl
B . NH4HCO3
C . NaHCO3
D . NaCl
将0.1mol/L的K2SO4溶液、0.2mol/L的Al2(SO4)3溶液和纯水混合,要使混合液中的K+、Al3+、SO42﹣的浓度分别为0.1mol/L、0.1mol/L、0.2mol/L,则所取的K2SO4溶液、Al2(SO4)3溶液、纯水三者体积比( )
A . 1:1:1
B . 2:1:2
C . 1:1:2
D . 2:1:1
硬水指的是含有哪些离子比较多( )
A . Ca2+、Mg2+
B . K+、Ca2+
C . Na+、Mg2+
D . K+、Mg2+
海水淡化可采用膜分离技术.如图所示,对淡化膜右侧的海水加压,水分子可以透过淡化膜进入左侧淡水池,而海水中其它各种离子不能通过淡化膜,从而得到淡水.对加压后右侧海水成分变化分析正确的是( )

A . 溶质质量增加
B . 溶液质量不变
C . 溶剂质量减少
D . 溶质质量分数减少
在一定温度下,向足量的饱和Na2CO3溶液中加入1.06克无水Na2CO3 , 搅拌后静置,最终所得晶体的质量( )
A . 等于1.06克
B . 大于1.06克而小于2.86克
C . 等于2.86克
D . 大于2.86克
某硫酸盐RSO4在t℃时溶解度为31.7g,在t℃时取足量RSO4的饱和溶液,向其中加入8.00g无水RSO4后,析出24.6g RSO4•7H2O晶体,则R为( )
A . Zn
B . Cu
C . Fe
D . Mg
将40℃的饱和硫酸铜溶液升温至50℃,或者温度仍保持在40℃而加入少量无水硫酸铜,在这两种情况下均保持不变的是( )
A . 硫酸铜的溶解度
B . 溶液的质量
C . 溶液中溶质的质量分数
D . 溶液中Cu2+的数目
如图为甲、乙两种物质的溶解度曲线图,请根据图回答下列问题.

-
(1) P点的意义是
-
(2) 若甲中混有少量乙,提纯甲的方法是
-
(3) 将接近饱和的乙的溶液变成饱和溶液的方法是
-
(4) t2℃时,50g水中溶解 g甲恰好达到饱和状态,此时溶液中溶质的质量分数为 (精确到0.1%).
-
(5) 将t2℃时甲和乙的饱和溶液分别降温到t1℃,两种溶液中溶质质量分数的关系是甲 (填“>”“<”或“=”)乙.
下列家庭小实验不能制得溶液的是( )
A .  B .
B .  C .
C .  D .
D . 
 B .
B .  C .
C .  D .
D . 
在一定温度下,向饱和烧碱溶液中加入一定量的过氧化钠,充分反应后恢复到原温度,下列说法正确的是( )
A . 溶液中有晶体析出,Na+数目不变
B . 溶液中有气体逸出,Na+数目增加
C . 溶质的质量分数增大
D . 溶液中Na+数目减少,溶质质量分数未变
下列图示与对应的叙述相符的是( )
A .  可表示将SO2气体通入溴水时pH的变化
B .
可表示将SO2气体通入溴水时pH的变化
B .  表示KNO3的溶解度曲线,a点是80℃的KNO3的不饱和溶液
C .
表示KNO3的溶解度曲线,a点是80℃的KNO3的不饱和溶液
C .  表示乙酸溶液中通入氨气至过量过程中溶液导电性的变化
D .
表示乙酸溶液中通入氨气至过量过程中溶液导电性的变化
D .  表示室温下,0.100mol/L NaOH溶液分别滴定0.100mol/L的盐酸和醋酸的滴定曲线,由图知I为盐酸的滴定曲线
表示室温下,0.100mol/L NaOH溶液分别滴定0.100mol/L的盐酸和醋酸的滴定曲线,由图知I为盐酸的滴定曲线
 可表示将SO2气体通入溴水时pH的变化
B .
可表示将SO2气体通入溴水时pH的变化
B .  表示KNO3的溶解度曲线,a点是80℃的KNO3的不饱和溶液
C .
表示KNO3的溶解度曲线,a点是80℃的KNO3的不饱和溶液
C .  表示乙酸溶液中通入氨气至过量过程中溶液导电性的变化
D .
表示乙酸溶液中通入氨气至过量过程中溶液导电性的变化
D .  表示室温下,0.100mol/L NaOH溶液分别滴定0.100mol/L的盐酸和醋酸的滴定曲线,由图知I为盐酸的滴定曲线
表示室温下,0.100mol/L NaOH溶液分别滴定0.100mol/L的盐酸和醋酸的滴定曲线,由图知I为盐酸的滴定曲线
都能用如图所示装置进行喷泉实验的一组气体是( )(烧杯内为 NaOH 溶液)

A . HCl 和 CO2
B . NH3 和 CH4
C . SO2 和 CO
D . NO2 和 NO
如图是A,B,C三种物质的溶解度曲线。下列叙述正确的是( )

A . t1℃时,三种物质溶解度大小顺序为A>B>C
B . t1℃时,A的饱和溶液中溶质的质量分数为10%
C . t2℃时,A,B,C的溶液的溶质质量分数一定相等
D . t3℃时,等质量的A,B,C的饱和溶液降温到t2℃时所得溶液溶质质量分数由大到小顺序是A=B>C
甲、乙两物质的溶解度曲线如图所示。下列叙述中正确的是( )

A . t1℃时,在100 g水中放入60 g甲,其溶质的质量分数为37. 5%
B . t1℃时,甲和乙的饱和溶液的物质的量浓度一定相等
C . t2℃时,甲和乙的饱和溶液中溶质的质量分数一定相等
D . t2℃时,分别在100 g水中各溶解20 g甲、乙,同时降低温度,甲先达到饱和
“皮鞋很忙”的恶搞段子曾经风靡网络,揭露了某些行业用烂皮鞋制造酸奶或毒胶囊的不法行为。央视《每周质量报告》曝光了河北省一些明胶企业将皮革废料熬制成工业明胶,出售给浙江绍兴某些制药企业,最终变成药用胶囊。由工业明胶制成的胶囊往往含有超标的重金属铬,会对人体造成伤害。明胶是水溶性蛋白质混合物,溶于水形成胶体。
-
(1) 已知
 中铬元素是+3价,则其中铁元素是价。
中铬元素是+3价,则其中铁元素是价。  是一种酸根离子,则
是一种酸根离子,则  属于(填“酸”“碱”“盐”或“氧化物”)。
属于(填“酸”“碱”“盐”或“氧化物”)。
-
(2) 明胶的水溶液和
 溶液共同具备的性质是(填序号)。
溶液共同具备的性质是(填序号)。 a.都不稳定,密封放置沉淀
b.能产生丁达尔效应
c.分散质粒子可通过滤纸
-
(3) 现有10mL明胶的水溶液与5mL
 溶液混合装入半透膜内,将此半透膜袋浸入盛蒸馏水的烧杯中,设计实验证明
溶液混合装入半透膜内,将此半透膜袋浸入盛蒸馏水的烧杯中,设计实验证明  能够透过半透膜:。
能够透过半透膜:。
下列有关说法正确的是( )
A . 使用广泛pH试纸测量“84”消毒液的pH
B . 反应 在一定条件能自发进行的原因是
在一定条件能自发进行的原因是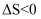 C . 常温下,将稀
C . 常温下,将稀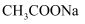 溶液加水稀释后,恢复至原温度,pH减小、
溶液加水稀释后,恢复至原温度,pH减小、 不变
D . 常温下,向
不变
D . 常温下,向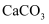 悬浊液中加入少量水,所得新悬浊液中c(Ca2+)减小
悬浊液中加入少量水,所得新悬浊液中c(Ca2+)减小
 在一定条件能自发进行的原因是
在一定条件能自发进行的原因是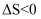 C . 常温下,将稀
C . 常温下,将稀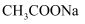 溶液加水稀释后,恢复至原温度,pH减小、
溶液加水稀释后,恢复至原温度,pH减小、 不变
D . 常温下,向
不变
D . 常温下,向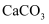 悬浊液中加入少量水,所得新悬浊液中c(Ca2+)减小
悬浊液中加入少量水,所得新悬浊液中c(Ca2+)减小
最近更新



