高一化学上学期上册试题
回答下列问题。
(1)xg H2O中含有y个氢原子,则阿伏加德罗常数为 。(用x、y表示)
(2)200mL 2mol•L﹣1MgCl2溶液中Cl﹣物质的量浓度为 。
(3)已知常温下,在溶液中可发生如下两个离子反应:Ce4++Fe2+=Fe3++Ce3+;
Sn2++2Fe3+=2Fe2++Sn4+。由此可确定溶液中离子的还原性强弱顺序为 。
(4)某一反应体系中有反应物和生成物共六种物质:Fe(NO3)3、FeSO4、HNO3、H2SO4、NO、H2O。请补充完整并配平下列方程式。
HNO3 + = + + +
下列有关说法正确的是( )
A. 氯化钠溶液均一稳定透明,不是分散系
B. 冰水混合物是一种分散系
C. 分散系有的是纯净物有的是混合物
D. 分散系都是混合物,按分散质和分散剂所处的状态,分散系的组合有9种方式
高一学生小强的化学笔记中有如下内容:你认为他的笔记中有几处错误( )
①物质按照组成可以分为单质和化合物
②单质又可分为金属和非金属
③化合物主要包括:酸、碱、盐和氧化物
④按照分散剂粒子直径大小可将分散系分为溶液、浊液和胶体
⑤只要在水溶液中能导电的化合物就是电解![]() 质
质
⑥按照树状分类法可将化学反应分为:氧化还原反应和离子反应
⑦氧化还原反应的本质是化合价升降.
A.三处 B.四处 C.五处 D.六处
甲、乙两烧杯中各盛有100 mL 3 mol·L-1的盐酸和NaOH溶液,向两烧杯中分别加入等质量的铝粉,反应结束后,测得生成的气体体积比为甲∶乙=1∶2,则加入铝粉质量为 ( )
A.5.4 g B.3.6 g
C.2.7 g D.1.8 g
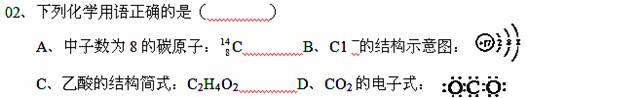
下列关于分散系的说法不正确的是( )
| A. 溶液、胶体、浊液属于不同的分散系 |
| B. 利用过滤的方法可以分离胶体和溶液 |
| C. 可利用丁达尔现象鉴别溶液和胶体 |
| D. 胶体与其他分散系的本质区别是胶体分散质粒子直径在1nm-100nm之间 |
下列有关溶液配制的说法正确的是
A. 在50mL量筒中配制0.1000mol/L氯化钠溶液
B. 配制一定物质的量浓度的溶液,定容时应仰视刻度线
C. 配制240mL0.1000mol/LH2SO4溶液需用250mL容量瓶
D. 将2.3gNa投入97.7g水中,可得质量分数为4%的烧碱溶液
在某体系内有反应物和生成物5种物质:FeCl3、FeCl2、H2S、S、HCl,已知FeCl2为生成物,则另一生成物是
A.FeCl3 B.H2S C.S D.HCl
NaHSO4在水溶液中能够电离H+、Na+和SO42-,下列对于NaHSO4的分类中不正确的是( )
A.NaHSO4是盐 B.NaHSO4是酸式盐
C.NaHSO4是钠盐 D.NaHSO4是酸
下列关于“燃烧”的说法错误的是( )
A. 燃烧一定伴有发光现象 B. 燃烧一定是氧化还原反应
C. 燃烧一定要有氧气参加 D. 氢气在氯气中燃烧产生苍白色火焰
.同温、同压下等质量的SO2气体和CO2气体,下列有关比较的叙述中,说法正确的是:
①分子数比为11:16 ②密度比为11:16 ③体积比为16:11 ④原子个数为11:16
A.①③ B.①④ C.②③ D.②④
一定条件下PbO2与Cr3+反应,产物是Cr 2 O72-和Pb2+![]() ,则与1.0 mol Cr3+ 反应所需PbO2的物质的量为______________mol
,则与1.0 mol Cr3+ 反应所需PbO2的物质的量为______________mol
下列各组离子在选项条件下一定能大量共存的是( )
A. 无色溶液:Na+、Fe2+、Cl-、 SO42- B. 酸性溶液:NH4+、 Fe3+、I-、SO42-
C. 遇酚酞变红的溶液:Na+、K+、SO42-、Cl- D. 碱性溶液:K+、Mg2+、SO42-、NO3-
现有24 mL浓度为0.05 mol·L-1的Na2SO3![]() 溶液恰好与20 mL浓度为0.02 mol·L-1的K2Cr2O7溶液完全反应。已知Na2SO3可被K2Cr2O7氧化为Na2SO4,则元素Cr在还原产物中的化合价为( )
溶液恰好与20 mL浓度为0.02 mol·L-1的K2Cr2O7溶液完全反应。已知Na2SO3可被K2Cr2O7氧化为Na2SO4,则元素Cr在还原产物中的化合价为( )
A.+2 B.+3 C.+4 D.+5
已知有如下反应:①2BrO3-+Cl2=Br2+2ClO3-, ②ClO3-+5Cl-+6H+=3Cl2+3H2O,③2FeCl3+2KI=2FeCl2+2KCl+I2, ④2FeCl2+Cl2=2FeCl3。
下列各微粒氧化能力由强到弱的顺序正确的是
A.ClO3->BrO3->Cl2>Fe3+>I2 B. BrO3->Cl2>ClO3->I2>Fe3+
C.BrO3->ClO3->Cl2>Fe3+>I2 D.BrO3->ClO3->Fe3+>Cl2>I2
.SO2 既有氧化性又有还原性,还有漂白性。下列对它变化中表现的性质标注正确的是:
① SO2使溴水褪色 (还原性) ② SO2使品红溶液褪色 (漂白性)
③ SO2通入氢硫酸(H2S)产生淡黄色浑浊 (氧化性)
④ SO2使润湿的蓝色石蕊试纸变红 (水溶液酸性)
A.只有①②④ B.只有③④ C.只有①③ D.①②③④
实验室用固体NaOH配制0.5 mol/L的NaOH溶液500 mL,①烧杯②100 ml量筒③容量瓶④药匙⑤玻璃棒⑥托盘天平⑦烧瓶
(1)配制时,必须使用的仪器有 (填代号),还缺少的仪器是 。
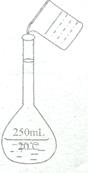
(2)在配制的转移过程中某学生进行如图操作,请指出其中的错误: 、 。
(3)配制时,一般可分为以下几个步骤①称量②计算③溶解④摇匀⑤转移⑥洗涤⑦定容⑧冷却。其正确的操作顺序为 。
(4)下列操作会使配制的溶液浓度偏低的是 (填字母)
A.没有将洗涤液转移到容量瓶 B.转移过程中有少量溶液溅出
C.容量瓶洗净后未干燥 D.定容时俯视刻度线
E.固体NaOH中含有少量Na2O杂质
(5)在容量瓶使用方法中,下列操作不正确的是(填序号)
A.使用容量瓶前检査它是否漏水
B.容量瓶用蒸馏水洗净后,再用碱液润洗
C.将氢氧化钠固体直接放在天平托盘的滤纸上,准确称量并放入烧杯中溶解后,立即注入容量瓶中
D.定容后塞好瓶塞,用食指顶住瓶塞,用另一只手的手指托住瓶底,把容量瓶倒转摇匀
关于100ml 1mol/LCaCl2溶液的叙述正确的是( )
A. Cl-的物质的量浓度为2mol/L B. CaCl2的物质的量为1mol
C.取出50 mL后,剩余溶液中CaCl2的物质的量浓度为0.5mol/L D.该溶液中水的体积为100 mL
属于氮的固定的是
A. 植物从土壤中吸收含氮养料
B. 豆科植物把含氮化合物转变为蛋白质
C. 将氨转化为硝酸,再转化为其他含氮化合物
D. 将空气中的氮气转化为含氮化合物
下列关于氧化还原反应的原理分析,正确的是
A.氧化剂氧化其他物质时,本身被还原
B.含有最高价元素的化合物一定具有强氧化性
C.失电子越多,该物质的还原性就越强
D.某元素由化合态变成游离态一定被还原



