дёӯиҖғеҢ–еӯҰиҜ•йўҳ
е°Ҷ10 gиҙЁйҮҸеҲҶж•°дёә20%зҡ„ж°ўж°§еҢ–й’ жә¶ж¶ІдёҺ10 gиҙЁйҮҸеҲҶж•°дёә20%зҡ„зӣҗй…ёж··еҗҲ,е……еҲҶеҸҚеә”еҗҺж»ҙе…Ҙзҙ«иүІзҹіи•Ҡжә¶ж¶І,жә¶ж¶ІеҸҳдёәВ В В (гҖҖгҖҖ)
A.зҙ«иүІВ B.и“қиүІВ C.зәўиүІВ D.ж— иүІ
й“қе…ғзҙ еңЁе…ғзҙ е‘ЁжңҹиЎЁдёӯзҡ„жҹҗдәӣдҝЎжҒҜеҸҠе…¶еҺҹеӯҗз»“жһ„зӨәж„ҸеӣҫеҰӮеӣҫгҖӮ

пјҲ 1 пјү й“қзҡ„зӣёеҜ№еҺҹеӯҗиҙЁйҮҸдёә ___________ пјӣ
пјҲ 2 пјү й“қеҺҹеӯҗеңЁеҢ–еӯҰеҸҚеә”дёӯжҳ“ ___________ ( еЎ« вҖң еҫ—еҲ° вҖқ жҲ– вҖң еӨұеҺ» вҖқ) з”өеӯҗпјӣ
пјҲ 3 пјү й“қеҢ–еӯҰжҖ§иҙЁжҙ»жіјпјҢиҖҢй“қеҲ¶е“ҒиЎЁйқўйҖҡеёёдёҚдҪңйҳІй”ҲеӨ„зҗҶпјҢжҳҜеӣ дёәй“қжҳ“ж°§еҢ–еҪўжҲҗиҮҙеҜҶзҡ„ ___________ ( еЎ«еҢ–еӯҰејҸ ) дҝқжҠӨиҶңгҖӮ
е®һйӘҢе®Өеёёз”ЁдәҢж°§еҢ–й”°дёҺжө“зӣҗй…ёеҸҚеә”еҲ¶еҸ–ж°Ҝж°”пјҢеҸҚеә”зҡ„еҢ–еӯҰж–№зЁӢејҸдёәпјҡ
MnO2+4HClпјҲжө“пјү![]() MnCl2+2X+Cl2вҶ‘пјҢе…¶дёӯXзҡ„еҢ–еӯҰејҸдёәпјҲ пјү
MnCl2+2X+Cl2вҶ‘пјҢе…¶дёӯXзҡ„еҢ–еӯҰејҸдёәпјҲ пјү
AпјҺH2OВ В В В В В В В В В В В В В В В В В В В В BпјҺH2O2В В В В В В В В В В В В В В В В В В В В В CпјҺHClOВ В В В В В В В В В В В В В В В В В В В DпјҺO2
дёӢеҲ—е®һйӘҢзҺ°иұЎжҸҸиҝ°жӯЈзЎ®зҡ„жҳҜ
A. з»Ҷй“ҒдёқеңЁж°§ж°”дёӯеү§зғҲзҮғзғ§пјҢзҒ«жҳҹеӣӣе°„пјҢз”ҹжҲҗеӣӣж°§еҢ–дёүй“Ғ
B. еҫҖй”ҢзІ’дёӯеҠ е…ҘзЁҖзЎ«й…ёпјҢдә§з”ҹж°”жіЎ
C. з”өи§Јж°ҙе®һйӘҢдёӯпјҢиҙҹжһҒдёҠдә§з”ҹзҡ„ж°”дҪ“дҪҝеёҰзҒ«жҳҹзҡ„жңЁжқЎеӨҚзҮғ
D. еҫҖж°ҜеҢ–й“ңжә¶ж¶Ідёӯж»ҙеҠ ж°ўж°§еҢ–й’ жә¶ж¶ІпјҢдә§з”ҹзәўиӨҗиүІжІүж·Җ
еҗҲйҮ‘жҳҜйҮҚиҰҒзҡ„йҮ‘еұһжқҗж–ҷ.

пјҲ1пјүMgпјҢAlжҢүе…¶дёҖе®ҡжҜ”дҫӢзҶ”еҗҲеҗҺеҶ·еҚҙеҸҜеҫ—еҲ°еӮЁж°ўеҗҲйҮ‘жқҗж–ҷгҖӮиҜҘиҝҮзЁӢеұһдәҺеҸҳеҢ–В В В В В В В пјҲйҖүеЎ«вҖңзү©зҗҶвҖқжҲ–вҖңеҢ–еӯҰвҖқпјү
пјҲ2пјүеӣҫдёӯиғҪиЎЁзӨәй”Ўй“…еҗҲйҮ‘зҡ„жҳҜ В В В В В В В В В В пјҲйҖүеЎ«вҖңaвҖқвҖңbвҖқжҲ–вҖңcвҖқпјү
вҖң84ж¶ҲжҜ’еүӮвҖқжҳҜд»Ҙж¬Ўж°Ҝй…ёй’ дёәдё»иҰҒжңүж•ҲжҲҗеҲҶзҡ„ж¶ҲжҜ’ж¶ІгҖӮеҲ¶еӨҮж¬Ўж°Ҝй…ёй’ зҡ„еҺҹзҗҶеҸҜиЎЁзӨәдёә:2NaOH + Cl2 = NaClO+X+H2OпјҢеҲҷXзҡ„еҢ–еӯҰејҸжҳҜ(В В )
AпјҺNa2OВ ![]() В В BпјҺNaCl
В В BпјҺNaCl ![]() В В В CпјҺNaH
В В В CпјҺNaH ![]() DпјҺNaClO3
DпјҺNaClO3
дёӢеҲ—иҜҙжі•жҲ–еҒҡжі•дёҚжӯЈзЎ®зҡ„жҳҜпјҲВ В В пјү
AпјҺжІ№й”…дёӯзҡ„жІ№зқҖзҒ«ж—¶з”Ёй”…зӣ–зӣ–зҒӯ
BпјҺеӨ©з„¶ж°”жі„жјҸз«ӢеҚіжү“ејҖжҺ’йЈҺжүҮйҖҡйЈҺ
CпјҺз”ЁзҶҹзҹізҒ°еҢәеҲҶж°ҜеҢ–й“өе’Ңж°ҜеҢ–й’ҫ
DпјҺз”ЁзҒјзғ§жі•йүҙеҲ«жЈүзәұзәҝе’ҢзҫҠжҜӣзәҝ
зЁҖеңҹжңү вҖңе·Ҙдёҡз»ҙз”ҹзҙ вҖқзҡ„зҫҺиӘүгҖӮй“ҲжҳҜдёҖз§Қеёёи§Ғзҡ„зЁҖеңҹе…ғзҙ пјҢй“Ҳе…ғзҙ зҡ„дҝЎжҒҜеҰӮеӣҫжүҖзӨәгҖӮдёӢеҲ—иҜҙжі•й”ҷиҜҜзҡ„жҳҜ

A пјҺ й“Ҳзҡ„еҺҹеӯҗеәҸж•°дёә 58 B пјҺ й“ҲеҺҹеӯҗдёӯзҡ„иҙЁеӯҗж•°дёә 58
C пјҺ й“ҲеұһдәҺйҮ‘еұһе…ғзҙ D пјҺ й“Ҳзҡ„зӣёеҜ№еҺҹеӯҗиҙЁйҮҸдёә 140.1g
е‘јеҗёиҮӘж•‘еҷЁжҳҜдәәеңЁзјәж°§зҺҜеўғжҲ–еҮәзҺ°й«ҳжө“еәҰжңүжҜ’жңүе®іж°”дҪ“зҺҜеўғдёӯдҪҝз”Ёзҡ„дёҖз§Қе®үе…ЁйҳІжҠӨиЈ…зҪ®гҖӮеҰӮеӣҫжҳҜжҹҗеҢ–еӯҰж°§иҮӘж•‘еҷЁзҡ„зӨәж„ҸеӣҫпјҢе…¶дҫӣж°§иЈ…зҪ®з”ұ вҖң еҲқжңҹз”ҹж°§еҷЁ вҖқ е’Ң вҖң з”ҹж°§зҪҗ вҖқ з»„жҲҗеҗҢеӯҰ们еҜ№е…¶е·ҘдҪңеҺҹзҗҶиҝӣиЎҢдәҶеҰӮдёӢжҺўз©¶пјҡ

в… . жҺўз©¶ вҖң еҲқжңҹз”ҹж°§еҷЁ вҖқ
пјҲжҹҘйҳ…иө„ж–ҷ 1 пјү
в‘ иҜҘеҢ–еӯҰж°§иҮӘж•°еҷЁеңЁе·ҘдҪңеҲқжңҹпјҢеҶ…йғЁзӢ¬з«Ӣзҡ„ вҖң еҲқжңҹз”ҹж°§еҷЁ вҖқ йҰ–е…ҲеҗҜеҠЁпјҢд»Ҙи§ЈеҶіеҲқжңҹдҫӣж°§дёҚи¶ізҡ„й—®йўҳгҖӮ вҖң еҲқжңҹз”ҹж°§еҷЁ вҖқ еҶ…жңүж°Ҝй…ёй’ҫгҖҒдәҢж°§еҢ–й”°гҖҒй“ҒзІүзӯүжҲҗеҲҶгҖӮ
в‘Ў Fe 3 O 4 иғҪдёҺзЎ«й…ёеҸҚеә”пјҢе…¶еҢ–еӯҰеҸҚеә”ж–№зЁӢејҸдёәпјҡ Fe 3 O 4 +4H 2 SO 4 =Fe 2 (SO 4 ) 3 +FeSO 4 +4H 2 O
пјҲ 1 пјү вҖң еҲқжңҹз”ҹж°§еҷЁ вҖқ дё»иҰҒдҫқйқ ж°Ҝй…ёй’ҫе’ҢдәҢж°§еҢ–й”°еҲ¶ж°§пјҢе…¶еҢ–еӯҰеҸҚеә”ж–№зЁӢејҸдёә ______________ гҖӮ
пјҲ 2 пјүе°Ҹз»„жҲҗе‘ҳдёәдәҶи§Јй“ҒзІүзҡ„дҪңз”Ёеұ•ејҖдәҶз ”з©¶гҖӮ
пјҲе®һйӘҢжҺўз©¶ 1 пјү
| еәҸеҸ· | е®һйӘҢжӯҘйӘӨ | е®һйӘҢзҺ°иұЎ | е®һйӘҢз»“и®ә |
| в‘ | еҸ– вҖң еҲқз”ҹж°§еҷЁ вҖқ е……еҲҶеҸҚеә”еҗҺзҡ„зү©иҙЁдәҺзәёдёҠпјҢе°ҶзЈҒй“Ғйқ иҝ‘并жҺҘи§ҰзІүжң« | жңүй»‘иүІзү©иҙЁиў«зЈҒй“Ғеҗёеј• | иў«еҗёеј•зү©иҙЁеҸҜиғҪжҳҜ Fe гҖҒ Fe 3 O 4 жҲ–дёӨиҖ…йғҪжңү |
| в‘Ў | еҸ–в‘ дёӯиў«й“Ғеҗёеј•зҡ„зү©иҙЁдәҺиҜ•з®ЎдёӯпјҢеҗ‘е…¶дёӯеҠ е…Ҙи¶ійҮҸзЁҖзЎ«й…ё | еӣәдҪ“е®Ңе…Ёжә¶и§ЈпјҢеҫ—еҲ°жҫ„жё…зҡ„й»„иүІжә¶ж¶І | иў«еҗёеј•зү©иҙЁдёӯдёҖе®ҡеҗ«жңү __________ ( еЎ«еҢ–еӯҰејҸ ) |
пјҲ 3 пјү вҖң еҲқжңҹз”ҹж°§еҷЁ вҖқ дёӯй“ҒзІүдёҺж°§ж°”еҸҚеә”иғҪ __________ пјҢд»ҺиҖҢдҪҝж°Ҝй…ёй’ҫзҡ„еҲҶи§ЈеҸҚеә”иғҪжҢҒз»ӯиҝӣиЎҢгҖӮ
в…Ў . жҺўз©¶ вҖң з”ҹж°§зҪҗ вҖқ
пјҲжҹҘйҳ…иө„ж–ҷ 2 пјү
в‘ иҜҘеҢ–еӯҰж°§иҮӘж•‘еҷЁдё»дҪ“жҳҜз”ұ вҖң з”ҹж°§зҪҗ вҖқ дҫӣж°§пјҢеҶ…йғЁиЈ…жңүйў—зІ’зҠ¶и¶…ж°§еҢ–й’ҫдҪңдёә вҖң еҲ¶ж°§еүӮ вҖқ пјҢе…¶еҸҚеә”еҺҹзҗҶдёәпјҡ 4KO 2 +2H 2 O=4KOH+3O 2 вҶ‘ пјӣ 4KO 2 +2CO 2 =2K 2 CO 3 +3O 2
в‘Ўи¶…ж°§еҢ–й’ҫиғҪдёҺзЎ«й…ёеҸҚеә”пјҢе…¶еҢ–еӯҰеҸҚеә”ж–№зЁӢејҸдёәпјҡ 4KO 2 +2H 2 SO 4 =2K 2 SO 4 +3O 2 вҶ‘+2H 2 O
пјҲе®һйӘҢжҺўз©¶ 2 пјү
еҗҢеӯҰ们еҜ№и¶…ж°§еҢ–й’ҫжҳҜеҗҰеҸҳиҙЁеұ•ејҖдәҶз ”з©¶пјҢеҸ–еҮәд№…зҪ®зҡ„ вҖң з”ҹж°§зҪҗ вҖқ еҶ…йў—зІ’зҠ¶еӣәдҪ“пјҢз§°еҫ—ж ·е“ҒиҙЁйҮҸдёә 69.3g пјҢиҝӣиЎҢеҰӮеӣҫжүҖзӨәе®һйӘҢпјҢеҫ…е®һйӘҢз»“жқҹжөӢеҫ— C иЈ…зҪ®еўһйҮҚ 2.2g пјҢ E иЈ…зҪ®еҶ…еӣәдҪ“еҸҳй»’иүІдё”еўһйҮҚ 19.2g( е®һйӘҢеүҚе·ІжҺ’е°ҪиЈ…зҪ®еҶ…з©әж°”пјҢдҪҝз”Ёзҡ„иҚҜе“ҒеқҮи¶ійҮҸ )

пјҲ 1 пјүеҸҚеә”ејҖе§ӢеҗҺ A иЈ…зҪ®дёӯйҖҡе…Ҙ N 2 зҡ„зӣ®зҡ„жҳҜ _________ гҖӮ
пјҲ 2 пјү E иЈ…зҪ®дёӯеҸ‘з”ҹеҸҚеә”зҡ„еҢ–еӯҰеҸҚеә”ж–№зЁӢејҸдёә __________ гҖӮ
пјҲ 3 пјүи¶…ж°§еҢ–й’ҫ ________ ( йҖүеЎ« вҖң жңӘ вҖқвҖң йғЁеҲҶ вҖқ жҲ– вҖң е…ЁйғЁ вҖқ) еҸҳиҙЁгҖӮ
пјҲ 4 пјүз”ҹдә§иҜҘ вҖң з”ҹж°§зҪҗ вҖқ ж—¶еҠ е…Ҙзҡ„и¶…ж°§еҢ–й’ҫзҡ„иҙЁйҮҸдёә ________ е…ӢгҖӮ
жҹҗеҢ–еӯҰе…ҙи¶Је°Ҹз»„еҜ№еӨұеҺ»ж Үзӯҫзҡ„зЁҖзЎ«й…ёжә¶ж¶Ізҡ„жө“еәҰиҝӣиЎҢжөӢе®ҡпјҡеҸ–зЁҖзЎ«й…ё50gдәҺзғ§жқҜдёӯпјҢйҖҗж»ҙж»ҙеҠ жә¶иҙЁзҡ„иҙЁйҮҸеҲҶж•°дёә3.42%зҡ„ж°ўж°§еҢ–й’Ўжә¶ж¶Іе№¶жҢҜиҚЎпјҢе……еҲҶеҸҚеә”еҗҺпјҢзғ§жқҜеҶ…зҡ„жә¶ж¶Ідёӯжә¶иҙЁиҙЁйҮҸдёҺж»ҙеҠ ж°ўж°§еҢ–й’Ўжә¶ж¶ІиҙЁйҮҸе…ізі»еҰӮеӣҫжүҖзӨә
(1)еҪ“ж»ҙеҠ Ba(OH)2жә¶ж¶І50gж—¶пјҢзғ§жқҜеҶ…жә¶ж¶Ізҡ„pH______7(еЎ«вҖң>вҖқвҖң<вҖқжҲ–вҖң=вҖқ)
(2)жұӮиҜҘзЁҖзЎ«й…ёжә¶ж¶Ізҡ„жә¶иҙЁзҡ„иҙЁйҮҸеҲҶж•°(еҶҷеҮәзӯ”йўҳиҝҮзЁӢ)гҖӮ
(3)ж»ҙеҠ Ba(OH)2жә¶ж¶ІиҮі150gж—¶пјҢжүҖеҫ—жә¶ж¶Ізҡ„жә¶иҙЁзҡ„иҙЁйҮҸеҲҶж•°дёә______(и®Ўз®—з»“жһңзІҫзЎ®еҲ°0.01%)

ж°ҙжҳҜеёёз”Ёжә¶еүӮпјҢжҹҗеҗҢеӯҰиҝӣиЎҢеҰӮеӣҫе®һйӘҢгҖӮ

пјҲ 1 пјүеҖҫж–ң A иҜ•з®ЎпјҢжІҝеҶ…еЈҒзј“зј“еҠ е…Ҙд№ҷйҶҮпјҢдёҚжҢҜиҚЎпјҢзҺ°иұЎжҳҜ ______ гҖӮ
пјҲ 2 пјүе®һйӘҢеҸҜзҹҘпјҢжә¶иҙЁзҠ¶жҖҒеҸҜд»ҘжҳҜ ______ гҖӮ
пјҲ 3 пјүе®һйӘҢз»“жқҹеҗҺпјҢз”Ёжҙ—ж¶ӨеүӮжҙ—еҮҖ B иҜ•з®ЎпјҢеҺҹзҗҶжҳҜ ______ гҖӮ
пјҲ 4 пјү C гҖҒ D иҜ•з®Ўзҡ„еәҹж¶ІеҖ’е…Ҙеәҹж¶Ізјёдёӯдә§з”ҹдәҶй»„з»ҝиүІж°”дҪ“пјҢжҹҘйҳ…иө„ж–ҷеҸҜзҹҘпјҡ пјҢ X зҡ„еҢ–еӯҰејҸдёә ______ гҖӮ
пјҲ 5 пјүиҜўй—®иҖҒеёҲеҫ—зҹҘз”Ё 
з”ІгҖҒд№ҷгҖҒдёҷдёүз§Қзү©иҙЁзҡ„иҪ¬еҢ–е…ізі»и§ҒдёӢйқўеҰӮеӣҫжүҖзӨә,вҖң![]() вҖқиЎЁзӨәеҸҚеә”еҸҜд»ҘдёҖжӯҘе®һзҺ°
вҖқиЎЁзӨәеҸҚеә”еҸҜд»ҘдёҖжӯҘе®һзҺ°![]() йғЁеҲҶзү©иҙЁе’ҢеҸҚеә”жқЎд»¶е·ІзңҒз•Ҙ
йғЁеҲҶзү©иҙЁе’ҢеҸҚеә”жқЎд»¶е·ІзңҒз•Ҙ![]() ,дёӢйқўйҖүйЎ№дёӯ,дёҚиғҪе®һзҺ°еӣҫзӨәиҪ¬еҢ–е…ізі»зҡ„жҳҜпјҲгҖҖгҖҖпјү
,дёӢйқўйҖүйЎ№дёӯ,дёҚиғҪе®һзҺ°еӣҫзӨәиҪ¬еҢ–е…ізі»зҡ„жҳҜпјҲгҖҖгҖҖпјү

| йҖүйЎ№ | з”І | д№ҷ | дёҷ |
| A |
|
|
|
| B | NaOH | NaCl |
|
| C | C | CO |
|
| D |
|
|
|
ж №жҚ®еӣҫзӨәе®һйӘҢ,дёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜ

A.ж°ҜеҢ–й’ жә¶ж¶ІдёҚиғҪжә¶и§Је…¶д»–зү©иҙЁВ В В В В В В В В В B.20 mLж°ҙдёӯжә¶и§Јж°ҜеҢ–й’ зҡ„жңҖеӨ§иҙЁйҮҸжҳҜе®ҡеҖј
C.еҠ зғӯеҗҺжә¶ж¶ІдёӯзЎқй…ёй’ҫзҡ„иҙЁйҮҸеҲҶж•°еҸҳеӨ§В В В В В В D.еҠ зғӯеҗҺзЎқй…ёй’ҫжә¶ж¶ІжҳҜдёҚйҘұе’Ңжә¶ж¶І
дёӢеҲ—еӣҫеғҸиғҪжӯЈзЎ®еҸҚжҳ еҜ№еә”еҸҳеҢ–е…ізі»зҡ„жҳҜ

A.еӣҫв‘ ,з”Ёж°Ҝй…ёй’ҫеҲ¶еҸ–ж°§ж°”
B.еӣҫв‘Ў,еҗ‘дёҖе®ҡйҮҸзҡ„NaHCO3жә¶ж¶Ідёӯж»ҙеҠ зЁҖзӣҗй…ё
C.еӣҫв‘ў,еҗ‘зӣӣжңүдёҖе®ҡиҙЁйҮҸNaOHе’ҢNa2CO3ж··еҗҲжә¶ж¶Ізҡ„зғ§жқҜдёӯж»ҙеҠ зЁҖзӣҗй…ё
D.еӣҫв‘Ј,еңЁдёҖе®ҡжё©еәҰдёӢ,еҗ‘жҺҘиҝ‘йҘұе’Ңзҡ„ж°ҜеҢ–й’ҫжә¶ж¶ІдёӯеҠ е…Ҙж°ҜеҢ–й’ҫеӣәдҪ“
(2019В·жңқйҳіжңҹжң«)зЎ…(Si)жҳҜеӨ©е®«дёҖеҸ·еҠЁеҠӣжәҗеӨӘйҳіиғҪз”өжұ зҡ„дё»иҰҒжһ„жҲҗжқҗж–ҷгҖӮзЎ…жҳҜз”ұзҹіиӢұ(SiO2)еӣәдҪ“дёҺзўіеңЁй«ҳжё©жқЎд»¶дёӢеҸҚеә”еҲ¶еҫ—зҡ„,еҗҢж—¶з”ҹжҲҗдёҖз§ҚеҸҜзҮғжҖ§ж°”дҪ“,иҜҘеҸҚеә”зҡ„еҢ–еӯҰж–№зЁӢејҸдёәгҖҖгҖҖгҖҖгҖҖгҖҖгҖҖгҖҖгҖҖгҖҖгҖҖгҖҖгҖҖ,еҹәжң¬еҸҚеә”зұ»еһӢжҳҜгҖҖВ В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В гҖӮВ
йҮ‘еұһжқҗж–ҷеә”з”Ёе№ҝжіӣгҖӮ
пјҲ 1 пјүдёӢеҲ—зү©е“Ғз”ұйҮ‘еұһжқҗж–ҷеҲ¶жҲҗзҡ„жҳҜ _______ пјҲеЎ«еӯ—жҜҚеәҸеҸ·пјүгҖӮ
| | | |
| A дёҚй”Ҳй’ўй”… | B зҙ«з ӮеЈ¶ | C жңЁеӢә |
пјҲ 2 пјүй“ҒжҳҜеә”з”ЁжңҖе№ҝжіӣзҡ„йҮ‘еұһжқҗж–ҷгҖӮеҶҷеҮәе·ҘдёҡдёҠз”ЁиөӨй“ҒзҹҝпјҲдё»иҰҒжҲҗеҲҶдёә Fe 2 O 3 пјүдёәеҺҹж–ҷиҝӣиЎҢй«ҳзӮүзӮјй“Ғзҡ„еҢ–еӯҰж–№зЁӢејҸпјҡ _______ гҖӮ
дёӢеҲ—е…ідәҺвҖңж°ҙвҖқзҡ„иҜҙжі•дёӯпјҢй”ҷиҜҜзҡ„жҳҜ
A. з”ҹжҙ»жұЎж°ҙеә”йӣҶдёӯеӨ„зҗҶе’ҢжҺ’ж”ҫ
B. иҝҮж»Өж“ҚдҪңиғҪйҷӨеҺ»ж°ҙдёӯзҡ„жүҖжңүжқӮиҙЁ
C. еҸҜз”ЁиӮҘзҡӮж°ҙеҢәеҲҶиҪҜж°ҙе’ҢзЎ¬ж°ҙ
D. жҙ»жҖ§зӮӯеҸҜеҗёйҷ„ж°ҙдёӯжңүиҮӯе‘ізҡ„зү©иҙЁ
з©әж°”дёӯзҡ„жҹҗз§ҚжҲҗеҲҶеңЁйҖҡз”өж—¶иғҪеҸ‘еҮәдёҚеҗҢйўңиүІзҡ„е…үпјҢеҸҜеҲ¶жҲҗеӨҡз§Қз”ЁйҖ”зҡ„з”өе…үжәҗгҖӮиҜҘжҲҗеҲҶжҳҜ
A пјҺ ж°§ж°”
B пјҺ ж°®ж°”
C пјҺ зЁҖжңүж°”дҪ“
D пјҺ дәҢж°§еҢ–зўі
дёӢеҲ—е®һйӘҢж“ҚдҪңиғҪиҫҫеҲ°е®һйӘҢзӣ®зҡ„зҡ„жҳҜпјҲжӢ¬еҸ·еҶ…дёәжқӮиҙЁпјү
| йҖүйЎ№ | зү©иҙЁ | зӣ®зҡ„ | дё»иҰҒе®һйӘҢж“ҚдҪң |
| A | CH 4 гҖҒ CO гҖҒ N 2 | жЈҖйӘҢ | е°ҶзҮғзқҖзҡ„жңЁжқЎеҲҶеҲ«дјёе…ҘйӣҶ气瓶дёӯ |
| B | зЁҖ H 2 SO 4 гҖҒ Ca пјҲ OH пјү 2 жә¶ж¶ІгҖҒ NaNO 3 жә¶ж¶І | йүҙеҲ« | еҸ–ж ·пјҢж»ҙеҠ зўій…ёй’ жә¶ж¶І |
| C | KNO 3 гҖҒ NaCl | еҲҶзҰ» | еҸ–ж ·пјҢеҠ ж°ҙжә¶и§ЈпјҢи’ёеҸ‘з»“жҷ¶ |
| D | Fe пјҲ Fe 2 O 3 пјү | йҷӨжқӮ | еҸ–ж ·пјҢеҠ е…ҘзЁҖзӣҗй…ёпјҢиҝҮж»Ө |
A пјҺ A B пјҺ B C пјҺ C D пјҺ D
пјҲ2020В·й”ҰжұҹжЁЎжӢҹпјүжҲ‘еӣҪ科еӯҰ家жңҖж–°з ”еҲ¶еҮәдёҖз§Қж–°еһӢзҹіеўЁзғҜ-й“қз”өжұ пјҢжүӢжңәдҪҝз”Ёиҝҷз§Қз”өжұ пјҢе……з”өж—¶й—ҙзҹӯпјҢеҫ…жңәж—¶й—ҙй•ҝгҖӮзўігҖҒй“қе…ғзҙ зҡ„зӣёе…ідҝЎжҒҜеҰӮеӣҫжүҖзӨәпјҢдёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜпјҲВ пјүВ
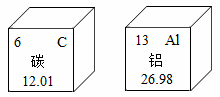
A.В зўіеҺҹеӯҗзҡ„ж ёз”өиҚ·ж•°дёә 6
B.В й“қзҡ„зӣёеҜ№еҺҹеӯҗиҙЁйҮҸдёә 26.98 g
C.В еңЁе…ғзҙ е‘ЁжңҹиЎЁдёӯзўіе…ғзҙ е’Ңй“қе…ғзҙ дҪҚдәҺеҗҢдёҖдёӘе‘Ёжңҹ
D.В зўігҖҒй“қе…ғзҙ зҡ„еҢ–еӯҰжҖ§иҙЁдёҚзӣёеҗҢжҳҜеӣ дёәе®ғ们зҡ„иҙЁеӯҗж•°дёҚеҗҢ






