福建省泉州实验中学2021届高三3月测试化学无纸试卷完整版
| 1. 选择题 | 详细信息 |
下图所示为海水综合利用的部分流程,下列有关说法错误的是( )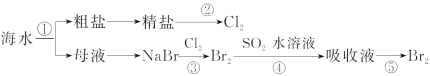 A.实验室进行①的操作需要用到坩埚、玻璃棒、酒精灯 B.②是一个将电能转化为化学能的过程 C.③④⑤涉及的反应均为氧化还原反应 D.④中反应的离子方程式为SO2+Br2+2H2O=4H++SO42-+2Br- |
|
| 2. 选择题 | 详细信息 |
以环戊二烯为原料,可制得环戊烷和金刚烷。下列说法错误的是( ) A.反应Ⅰ为加成反应 B.环戊二烯能使酸性高锰酸钾溶液褪色 C.环戊烷的二氯代物有4种 D.金刚烷的分子式为C10H16 |
|
| 3. 选择题 | 详细信息 |
|
NA为阿伏加德罗常数的值,下列叙述不正确的是 A. 46g乙醇完全燃烧,转移的电子数为12NA B. 0.2NA个CH4分子与足量氯气反应,生成物在标准状况下的体积为22.4L C. 1L 1 mol·L-1NH4NO3 溶液中NO3-的数目为NA D. 1mol Na与足量O2反应,产物中阴离子的数目为0.5NA |
|
| 4. 选择题 | 详细信息 |
某二元醇的结构简式为 ,关于该有机物的说法错误的是( ) ,关于该有机物的说法错误的是( )A.用系统命名法命名:5-甲基-2,5-庚二醇 B.该有机物通过消去反应能得到6种不同结构的二烯烃 C.该有机物可通过催化氧化得到醛类物质 D.1mol 该有机物能与足量金属 |
|
| 5. 选择题 | 详细信息 |
无水氯化铝是常用的有机化工试剂,易水解、易升华。实验室用以下装置制取少量氯化铝,反应原理为 A.圆底烧瓶中发生反应:NaCl+H2SO4(浓) B.粗导管d也可换成细导管 C.e中试剂可选用碱石灰、无水氯化钙或五氧化二磷 D.为了减少HCl的浪费,实验开始时先点燃b处酒精灯 |
|
| 6. 选择题 | 详细信息 |
|
短周期主族元素X、Y、Z和W的原子序数依次增大,X、Y、W位于不同周期,Y、Z、W的原子最外层电子数之和为14,Z的原子半径在短周期主族元素中最大。下列说法错误的是 A. 简单离子半径:W>Z>X B. Y、W均能与X形成共价化合物 C. W的最高价氧化物的水化物一定为强酸 D. Y与Z形成的化合物溶于水一定得到强碱溶液 |
|
| 7. 选择题 | 详细信息 |
|
我国科研人员发现了一种新型超导体 A. B.有关元素的电负性: C. D.该新型超导体的组成元素全部位于元素周期表p区 |
|
| 8. 选择题 | 详细信息 |
四丁基氢氧化铵[(C4H9)4NOH]常作电子工业清洗剂。以四丁基溴化铵[(C4H9)4NBr]为原料,采用电渗析法合成(C4H9)4NOH,原理如图(c、d、e为离子交换膜)。下列说法错误的是 A.M为负极 B.b极电极反应式:2H2O-4e-=O2↑+4H+ C.c、e分别为阳离子交换膜和阴离子交换膜 D.制备1mol (C4H9)4NOH,理论上a极产生11.2 L气体(标准状况下) |
|
| 9. 选择题 | 详细信息 |
|
Zewail创立的飞秒( A.中间产物 B.反应起点为 C. D.飞秒化学展现的反应历程为“化学反应实质是旧键断裂和新键形成”提供有力证据 |
|
| 10. 选择题 | 详细信息 |
|
酸在溶剂中的电离实质是酸中的 A. B. C.浓度均为 D.向  减小 减小 |
|
| 11. 实验题 | 详细信息 |
葡萄糖酸亚铁(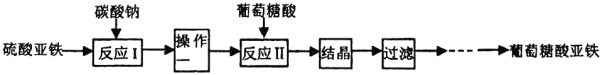 Ⅰ.用下图装备制备  (1)仪器 (2)反应开始时,先打开活塞 (3)操作一是___________。 (4)检验 (5)用 Ⅱ.制葡萄糖酸亚铁 (6)葡萄糖酸的分子式为___________。 (7)反应Ⅱ中加入过量葡萄糖酸使溶液显弱酸性,原因是___________。 (8)以上结晶的操作:往葡萄糖酸亚铁溶液加入___________。 |
|
| 12. | 详细信息 | ||||||||||||||||||||||||
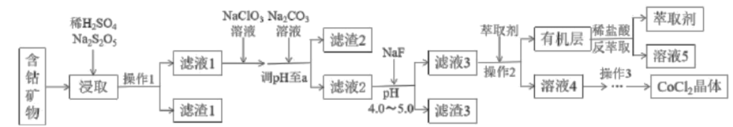 已知:①焦亚硫酸钠( ②25℃时, ③部分金属阳离子形成氢氧化物的
回答下列问题: |
|||||||||||||||||||||||||
| 13. | 详细信息 | ||||||||||||||||||||||||||||||||
|
(1)随着节能环保问题的提出,人们开始关注逆水煤气反应(RWGS)的研究。目前RWGS的历程主要有:氧化还原历程[如下图 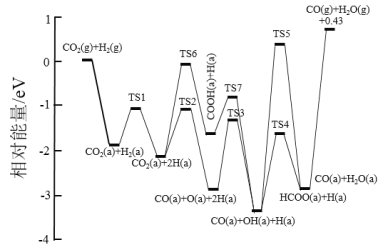 RWGS部分步骤的活化能E和反应热△H
①写出RWGS的热化学方程式___________ |
|||||||||||||||||||||||||||||||||
| 14. 填空题 | 详细信息 | ||||||||||||
|
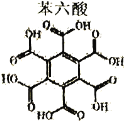
过渡金属广泛应用于材料、催化剂、电导体等,是化学工作者重点研究的对象。我国科学家成功研制出一系列石墨烯限域的 (1) (2)配离子的颜色与 (3)某含铜化合物的晶胞如图所示,晶胞上下底面为正方形,侧面与底面垂直。  ①晶胞中每个 ②该晶体高温煅烧生成 (4)石墨烯可采用化学方法进行制备,如采用六氯苯六溴苯作为原料可制备石墨烯。下表给出了六氯苯、六溴苯、苯六酸(俗名为蜜石酸)的熔点和水溶性:
①六溴苯的熔点比六氯苯高的原因是___________。 |
|||||||||||||
| 15. | 详细信息 |
化合物 回答下列问题: (1)E中官能团的名称是___________;⑤的反应类型是___________。 (2)通过反应②和反应⑧推知引入 (3)碳原子上连有4个不同的原子或基团时,该碳原子称为手性碳原子。写出 (4)写出⑨的反应方程式___________。 (5)满足以下条件,化合物 a.分子中含有苯环 b.分子中含有 |
|
- 海南省东方市八所中学2020-2021年高一上半期第三次月考化学免费试卷带答案和解析
- 高一上学期期末考试化学题同步训练免费试卷(2018-2019年湖南省长沙市雨花区)
- 2019-2020年高二下学期5月月考化学考试(山东省泰安市肥城市泰西中学)
- 2019-2020年高二下半期期中考试化学题免费试卷在线检测(湖南省常德市淮阳中学)
- 高二化学上册单元测试模拟考试练习
- 2018-2019年高二上册第三次月考化学考题(浙江省台州市书生中学)
- 高一后半期5月月考化学在线测验完整版(2019-2020年陕西省渭南市临渭区铁路自立中学)
- 2019-2020年高二上半期期中考试化学考试完整版(海南省海口市第四中学)