贵港市高一化学月考测验(2018年前半期)试卷带答案和解析
| 1. 选择题 | 详细信息 |
|
“钴酞菁”分子(直径约为1.34x10-9m)结构和性质与人体内的血红素及植物内的叶绿素非常相似。下列关于“钴酞菁”分子的说法中正确的是 A. “钴酞菁”分子在水中所形成的分散系属悬浊液 B. “钴酞菁”分子既能透过滤纸,也能透过半透膜 C. 在分散系中,“钴酞菁”分子直径比Na+的直径小 D. “钴酞菁”分子在水中形成的分散系能产生丁达尔现象 |
|
| 2. 选择题 | 详细信息 |
|
设阿伏加德罗常数为NA,则下列说法正确的是 A. 常温常压下,11.2 L甲烷中含有的氢原子数为2NA B. 标准状况下,0.3 mol二氧化硫中含有的氧原子数为0.3NA C. 常温常压下,2 g H2的分子数为NA D. 常温常压下,1 mol/L MgCl2溶液中含Cl﹣数为2NA |
|
| 3. 选择题 | 详细信息 |
|
下列离子方程式书写正确的是 A. 硫酸溶液中滴加氢氧化钡溶液:H++SO42-+Ba2++OH-=BaSO4↓+H2O B. 硫酸镁跟氢氧化钡反应:Ba2++SO42-=BaSO4↓ C. 向AgNO3溶液中加入铜粉:2Ag++Cu=Cu2++2Ag D. 氢氧化铜加到醋酸溶液中:Cu(OH)2+2H+=Cu2++2H2O |
|
| 4. 选择题 | 详细信息 |
|
一定能在下列溶液中大量共存的离子组是 A. 在强碱溶液中:Na+、K+、Cl-、SO32- B. 使酚酞变红色的溶液:Na+、Cu2+、HCO3-、NO3- C. 0.1 mol/L AgNO3溶液:K+、H+、Cl-、SO42- D. 0.1 mol/L Na2CO3溶液:K+、Ba2+、NO3-、Cl- |
|
| 5. 选择题 | 详细信息 |
向澄清饱和石灰水中通入二氧化碳,测得溶液导电性(I表示导电能力)的变化,以下与加入物质量的关系正确的是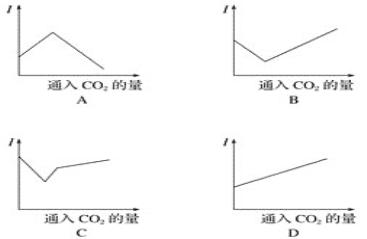 A. A B. B C. C D. D |
|
| 6. 填空题 | 详细信息 |
|
写出下列物质间反应的离子反应方程式: (1)向澄清的石灰水中缓慢通入二氧化碳气体____________________________; (2)氢氧化铜与稀硫酸反应______________________________________; (3)足量的CO2通入NaOH溶液_____________________________________; (4)氧化镁与稀硫酸反应________________________________________; (5)向NaHSO4溶液中逐滴加入Ba(OH)2溶液至中性,请写出发生反应的离子方程式:____________________________________________;在以上中性溶液中继续滴加Ba(OH)2溶液,请写出此步反应的离子方程式:_______。 |
|
| 7. 实验题 | 详细信息 |
|
离子反应实质上是离子之间的重新组合,生成难溶、易挥发的物质或水,利用离子反应可以进行物质的检验、除杂或制备。 (1)除去铁钉表面的铁锈 (成分是Fe2O3),将铁钉放入稀硫酸中,开始反应的离子方程式是_____________________________________________;反应片刻后,可观察到有气体产生,其离子方程式是_____________________。 (2)某同学拟用氯化钙固体、碳酸钠溶液和稀硝酸等试剂,先制得碳酸钙,最终制得纯净的硝酸钙晶体。 ①写出制取过程中反应的离子方程式:____________________、____________________。 ②请帮助该同学完成下列实验操作步骤(不要求回答使用的仪器) a.用蒸馏水完全溶解CaCl2后,加入____________。 b.将反应后的混合物过滤,并用适量蒸馏水洗涤沉淀至无Cl-。 c.加入____________,使沉淀完全溶解。 d.将所得溶液蒸发、结晶,得到纯净的硝酸钙晶体。 ③请简述证明沉淀已洗净的实验操作、现象及结论:____________________。 |
|
| 8. 实验题 | 详细信息 |
|
现有甲、乙、丙三名同学分别进行氢氧化铁胶体的制备实验。 甲同学:向1 mol·L-1的氯化铁溶液中加少量氢氧化钠溶液。 乙同学:直接加热饱和FeCl3溶液。 丙同学:向25 mL沸水中逐滴加入5~6滴氯化铁饱和溶液,继续煮沸至溶液呈红褐色,停止加热。 试回答下列问题: (1)其中操作正确的同学是____________,若丙同学实验中不停止加热,会看到___________。 (2)氢氧化铁胶体制备的化学方程式为_______________________________; (3)证明有氢氧化铁胶体生成利用的胶体性质是_______,提纯所制氢氧化铁胶体常用的方法是________。 (4)利用氢氧化铁胶体进行实验: ①将其装入U形管内,用石墨作电极,通电一段时间后发现与电源负极相连的电极区附近的颜色逐渐变深,这表明氢氧化铁胶体微粒带__________(填“正”或“负”)电荷; ②若向其中加入饱和硫酸钠溶液,产生的现象是________________________; ③若向其中逐滴加入稀盐酸,产生的现象是__________________________。 |
|
| 9. 实验题 | 详细信息 |
(一)电解法制碱的原料是饱和食盐水,由于粗盐中含有泥沙和Ca2+、Mg2+、Fe3+、SO42-杂质,不符合电解要求,因此必须经过精制。某校实验小组精制粗盐水的实验过程如下: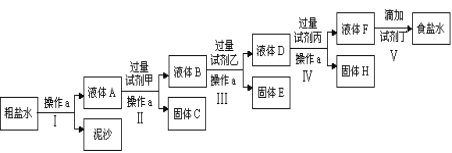 请回答以下问题: (1)操作a的名称是______________,所用玻璃仪器有_________________; (2)在第Ⅱ步中,加入过量试剂甲后,生成了两种大量的难溶沉淀,则试剂甲为(填化学式)_______________溶液; (3)写出固体H所含物质的化学式_________________________________; (4)在Ⅴ步中,逐滴加入试剂丁直至溶液无明显变化时,写出此过程中发生反应的离子方程式____________________________________________。 (二)某次实验需用0.4 mol·L-1 NaOH溶液500 mL。若在配制过程中出现下列情况,将使所配制的NaOH溶液的浓度偏低的是__________,对实验结果没有影响的是________(填字母代号)。 A.所用的NaOH中混有少量Na2O B.用托盘天平称量一定质量固体NaOH时,所用的小烧杯内壁不太干燥 C.配制溶液所用的容量瓶洗净后没有烘干 D.固体NaOH在烧杯中溶解后,立即将溶液转移到容量瓶内并接着进行后续操作 E.转移溶液后,未洗涤烧杯和玻璃棒就直接定容 F.最后确定NaOH溶液体积(定容)时,俯视观察液面与容量瓶刻度线 G.定容摇匀后静止,发现液面低于刻度线,再加蒸馏水至刻度线 |
|
最近更新



