高二后半期第三次月考化学免费试卷带答案和解析(2019-2020年河北保定一中)
| 1. 选择题 | 详细信息 |
|
下列能量转化过程中由化学能转化为电能的是( ) A.光伏发电  B.风力发电 B.风力发电 C.水力发电  D.燃料电池 D.燃料电池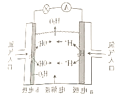 |
|
| 2. 选择题 | 详细信息 |
|
已知反应2SO2(g)+O2(g) A.v正减小,v逆增大,平衡逆向移动 B.v正增大,v逆减小,平衡正向移动 C.v正、v逆同时增大,平衡逆向移动 D.v正、v逆同时增大,平衡正向移动 |
|
| 3. 选择题 | 详细信息 |
|
常温下,若CH3COONa和CH3COOH的混合溶液的pH>7,则下列关系式正确的是 A.c(CH3COO-)=c(Na+) B.c(CH3COO-)>c(Na+) C.c(CH3COO-)<c(Na+) D.无法判断c(CH3COO—)与c(Na+)的大小 |
|
| 4. 选择题 | 详细信息 |
|
下列反应中的反应物总能量高于生成物总能量的是( ) A.氯化铵晶体与氢氧化钡晶体的反应 B.盐酸与氢氧化钠的中和反应 C.焦炭与二氧化碳高温下的化合反应 D.碳酸钙的分解反应 |
|
| 5. 选择题 | 详细信息 |
|
下列有关说法正确的是( ) A.合成氨生产中,为提高氢气的转化率,可增加氮气的量 B.二氧化硫的催化氧化反应,△H<0,故反应温度越低越好 C.△H>0、△S<0的反应在任何条件下都能发生反应 D.使用催化剂可以提高工业生产中合成氨的产率 |
|
| 6. 选择题 | 详细信息 |
|
恒容密闭容器中,反应X(s)+2Y(g) A.气体的密度不再变化 B.Y与Z的物质的量之比为2:3 C.气体的压强不再变化 D.生成Y与消耗X的物质的量之比为2:1 |
|
| 7. 选择题 | 详细信息 |
|
下列方程式书写正确的是( ) A.HCO B.NaHSO4在水溶液中的电离方程式:HSO C.CO D.向Na2CO3溶液中滴入少量稀盐酸,发生反应的离子方程式:2H++CO |
|
| 8. 选择题 | 详细信息 | |||||||||||||||
下列实验过程可以达到实验目的的是( )
|
||||||||||||||||
| 9. 选择题 | 详细信息 |
|
下列叙述不正确的是( ) A.要加热才能发生的反应也可能是放热反应 B.自然界中钢铁腐蚀主要是吸氧腐蚀 C.电解质的强弱也能影响电解质溶液的导电能力 D.明矾和漂白粉都可以用于自来水的净化和杀菌消毒 |
|
| 10. 选择题 | 详细信息 |
常温下,向pOH[pOH=-lgc(OH-)均为2的NaOH与YOH溶液中分别加水稀释,溶液pOH随溶液体积变化的曲线如图所下列说法正确的是( ) A.水的电离程度:a<b B.稀释到pOH均为3时,加水量:V水(NaOH)<V水(YOH) C.稀释前NaOH与YOH的物质的量浓度均为0.01mol•L-1 D.无限稀释时,NaOH与YOH的pOH仍按图示比例一直增大 |
|
| 11. 选择题 | 详细信息 |
|
在密闭容器中,一定量混合气体发生反应xA(g)+yB(g) A.x+y<p+q B.气体的平均摩尔质量增大 C.压缩体积时,平衡向逆反应方向移动 D.体系中混合气体的平均密度不变 |
|
| 12. 选择题 | 详细信息 |
A(g)+B(g) A.正反应与逆反应的活化能相等 B.加入催化剂后,△E、E1、E2均不变 C.一定条件下,1molA(g)与1molB(g)在密闭容器中充分反应,放出的热量等于△E D.图中反应的焓变为△E,该反应是吸热反应 |
|
| 13. 选择题 | 详细信息 |
炒过菜的铁锅未及时洗净(残液中含NaCl),不久便会因被腐蚀而出现红褐色锈斑。腐蚀原理如图所示,下列说法正确的是( ) A.腐蚀过程中,负极是C B.Fe失去电子经电解质溶液转移给C C.C是正极,O2在C表面上发生还原反应 D.正极的电极反应式为4OH-4e-=2H2O+O2↑ |
|
| 14. 选择题 | 详细信息 |
|
下列说法正确的是( ) A.为防止食品氧化变质,可在包装袋中放入还原性铁粉 B.用铝热反应2Al+Fe2O3 C.NH3的水溶液导电,所以NH3是电解质 D.洁厕灵(主要成分为盐酸)与“84”消毒液(主要成分为NaClO)混合使用清洁效果更佳 |
|
| 15. 选择题 | 详细信息 | ||||||||||||||||||||
往三个不同容积的恒容密闭容器中分别充入1 mol CO与2 mol H2,发生反应CO(g)+2H2(g)
|
|||||||||||||||||||||
| 16. 选择题 | 详细信息 |
常温下,将0.1mol•L-1的NH3•H2O逐滴滴入10mL0.1mol•L-1HR溶液中,所得溶液pH及导电性变化如图,下列分析正确的是( ) A.水电离出c(H+):b>a B.相同温度下,电离平衡常数:HR>NH3•H2O C.溶液中Kw:b>a=c D.c点溶液中:c(R-)>c(NH |
|
| 17. 填空题 | 详细信息 |
|
能源是人类生活和社会发展的基础,研究化学反应中的能量变化,有助于更好地利用化学反应为人们的生产和生活服务。请回答下列问题: (1)从能量的角度看,当反应物断开化学键吸收的总能量大于生成物形成化学键放出的总能量时,该反应为__(填“放热”或“吸热”)反应,△H__(填“>”或“<”)0。 (2)中和热测定实验中,用到的玻璃仪器有烧杯、量筒、温度计、__。已知0.25mol•L-1NaOH溶液与足量的稀醋酸反应放出13.25kJ热量,则该中和反应的热化学方程式为__。 (3)0.2mol液态高能燃料联氨(N2H4)在氧气中燃烧生成N2和液态水,放出124.25kJ热量,则其热化学方程式为__。 (4)CH3CH2OH(g)+H2O(g)=4H2(g)+2CO(g) △H=+256.6kJ•mol-1 2CH3CH2OH(g)+O2(g)=6H2(g)+4CO(g) △H=+27.6kJ•mol-1 H2O(g)=H2O(l) △H=-44kJ•mol-1 则常温下H2燃烧热的热化学方程式为__。 |
|
| 18. | 详细信息 |
一定条件下,向体积为2L的密闭容器中,充入2molCO2和6molH2,发生反应:CO2(g)+3H2(g) (1)保持体积不变,从反应开始至达到平衡,H2的平均反应速率v(H2)=__;CO2的平衡转化率a(CO2)=___。 (2)该反应的平衡常数K=__。 (3)15min时,把体积压缩到1L,请在图2中画出CO2和CH3OH(g)的浓度随时间变化的图像___。 (4)25℃、1.01×105Pa时,16g液态甲醇完全燃烧,当恢复到原状态时,放出350.8kJ的热量,写出该反应的热化学方程式:___。 (5)选用合适的合金为电极,以氢氧化钾、甲醇、水、氧气为原料,可以制成一种以甲醇为原料的燃料电池,其负极的电极反应式是__。 |
|
| 19. 实验题 | 详细信息 | ||||||||||||||||||
某研究性学习小组用浓度为0.20 mol·L-1的盐酸标准液滴定含有一定量杂质的烧碱样品(杂质与酸不反应)溶于水形成的溶液。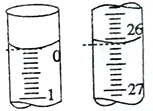 (1)准确量取一定体积的待测液需要使用的仪器是______________。 (2)若滴定开始和结束时,滴定管中的液面如图所示,则消耗盐酸标准液的体积为________mL。 (3)滴定时,若以酚酞为指示剂,滴定达到终点的标志是______________________________。 (4)将准确称取的5.0g烧碱样品配制成250mL 待测液,并用盐酸标准液滴定。滴定前读数及滴定后读数如下表所示。
|
|||||||||||||||||||
| 20. 填空题 | 详细信息 | ||||||||||||||||||||
|
请按要求回答下列问题: (1)25℃时,物质的量浓度均为0.1mol•L-1的几种盐溶液的pH如下表所示。
|
|||||||||||||||||||||
| 21. | 详细信息 |
某课外小组分别用如图所示装置对原电池和电解池的原理进行实验探究。 请回答: Ⅰ.用图1所示装置进行第一组实验。 (1)实验过程中N极附近变红,左边反应原理为Zn+CuCl2=ZnCl2+Cu。电极M是__极,电极反应式为___。 (2)若实验过程中有0.4mol电子转移,则有___molCl-通过隔膜。 Ⅱ.用如图2所示装置进行第二组实验。实验过程中,两极均有气体产生,Y极区逐渐产生蓝色沉淀;停止实验,铜电极明显变细,电解液仍然澄清;分别收集两极产生的气体进行实验,发现其中一种气体可在另一种气体中燃烧,据此回答下列问题。 (3)Y极产生的气体为___(填化学式),产生该气体的电极反应式为__。 (4)电解过程中,X极区溶液的pH__(填“增大“减小”或“不变”)。 (5)若在X极收集到672mL气体时,Y极收集到168mL气体(均已折算为标准状况下的气体体积),则Y电极( |
|



