运城市高三化学上册期末考试模拟考试训练
| 1. 选择题 | 详细信息 |
|
化学与生产生活息息相关,下列有关说法正确的是 A.《鹤林玉露·一钱斩史》中记载“一日一钱,千日千钱,绳锯木断,水滴石穿”不涉及化学变化 B.“五粮液”酿酒的原理是通过蒸馏法将高粱等粮食中的乙醇分离出来 C.古成语“刀耕火种”,其化学原理是以灰肥田,并可以有效降低土壤的酸度 D.瓷器烧制前后颜色不同的现象称为“窑变”,“窑变”属于物理变化 |
|
| 2. 选择题 | 详细信息 |
下列实验操作、现象和所得结论均正确的是 A.A B.B C.C D.D |
|
| 3. 选择题 | 详细信息 |
下列有关部分螺环化合物的说法正确的是 A.三种化合物中c中的所有碳原子一定共面 B.b与c均可以使溴水和高锰酸钾溶液褪色,且褪色的原理相同 C.b与乙烯互为同系物 D.a的二氯代物超过9种结构 |
|
| 4. 选择题 | 详细信息 |
|
短周期主族元素W、X、Y、Z的原子序数逐渐增大,W是一种制备高效电池的重要材料。X和Z同主族,X的最外层电子数是其电子层数的三倍。Y单质可用于野外焊接钢轨。下列说法不正确的是 A.Y、W、氢三种元素形成的一种化合物可以作为生氢剂 B.X的氢化物比Z的氢化物更加稳定沸点也更高 C.简单离子半径Z>Y>X>W D.W与水反应置换出氢气比Y容易 |
|
| 5. 选择题 | 详细信息 |
|
液态锂离子电池是指Li+嵌入化合物为正负极的二次电池。正极采用锂化合物LiCoO2,负极采用碳电极,充电后成为锂-碳层间化合物LixC6(0<x≤1),电解质为溶解有锂盐充电LiPF6、LiAsF6等的有机溶液。该电池的反应为:LiCoO2+6C A.LiCoO2改写成为氧化物的形式为Li2O·Co2O3 B.该电池的电解质溶液使用有机溶剂主要是由于有机溶剂有良好的导电性 C.该电池放电时正极反应式:Li1-xCoO2+xe-+xLi+=LiCoO2 D.充电时,Li+从LiCoO2中脱嵌通过电解质溶液嵌入碳层 |
|
| 6. 选择题 | 详细信息 |
NaClO2是一种重要的杀菌消毒剂,也常用来漂白织物等,其一种生产工艺如下:下列有关说法不正确的是 A.NaClO2中Cl的化合价+3价 B.“反应”步骤中生成ClO2的化学方程式2NaClO3+SO2+H2SO4=2ClO2+2NaHSO4 C.“电解”所用食盐水由粗盐水精制而成,精制时,为除去Mg2+和Ca2+,要加入的试剂分别为NaOH溶液和Na2CO3溶液 D.“尾气吸收”是吸收“电解”过程排出的少量ClO2,反应中,氧化剂与还原剂的物质的量之比为1:2 |
|
| 7. 选择题 | 详细信息 |
25℃时,用0.100 mol/L盐酸溶液滴定25.00 mL 0.100 mol/L的氨水溶液,滴定曲线如图所示,下列有关说法不正确的是 A.可用甲基橙指示剂 B.a点所示溶液中,c(NH4+)>c(NH3·H2O)>c(Cl-)>c(OH-)>c(H+) C.水的电离程度b点所示溶液大于a点所示溶液 D.c点所示溶液中,c(Cl-)+2c(OH-)=2c(H+)-2c(NH3·H2O) |
|
| 8. 实验题 | 详细信息 |
|
ClO2是一种国际上公认的安全无毒的绿色水处理剂。ClO2易爆炸,若用“惰性气体”等稀释时,爆炸性则大大降低。某化学小组用如图所示装置制备ClO2并处理废水。回答下列问题: (1)仪器A的作用是__________,C装置的作用为__________。 (2)装置B中发生反应的离子方程式为______________________________。选用以上试剂制备ClO2的优点是______________________________。 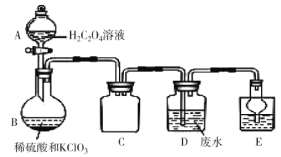 (3)ClO2可与工业废水中CN-反应生成对大气无污染的气体,该反应中氧化剂和还原剂的物质的量之比为__________。 (4)有同学认为装置B反应后的溶液中可能存在Cl-,请设计实验验证。简要写出所需试剂、实验操作、现象和结论(已知AgClO3可溶于水)______________________________________。 (5)二氧化氯也可采用电解法生产:4ClO3-+2H2O |
|
| 9. 综合题 | 详细信息 |
|
氮及其化合物在工农业生产、生活中有重要作用。请按要求回答下列相关问题: (1)食品添加剂铵明矾NH4Al(SO4)2·12H2O高温可分解,下列关于其分解产物的预测不合理的是_______。 A.NH3、N2、SO2、H2O B.NH3、SO3、H2O C.NH3、SO2、H2O D.NH3、N2、SO3、SO2、H2O (2)肼(N2H4)又称联氨,是一种可燃性液体,用作火箭燃料。 ①肼的电子式___________。 ②64.0克肼在氧气中完全燃烧生成氮气和液态水放出热量1248kJ(在101kPa,25℃),则表示肼燃烧热的热化学方程式为________________________________________。 (3)工业合成氨的反应:N2(g)+3H2(g)  ①比较在m、n、q三点所处的平衡状态中,反应物N2的转化率最高的是__________点。 ②图像中T2______T1(填“高于”、“低于”、“等于”或“无法确定”),理由是____________。 ③在绝热容器中进行该反应时,压缩容器体积,平衡常数__________(填“变大”“变小”或“不变”)。 |
|
| 10. | 详细信息 |
废旧印刷电路板是一种电子废弃物。湿法技术是将粉碎的印刷电路板经溶解、萃取、电解等操作得到纯铜等产品,从而达到从废旧印刷电路板中提取铜的目的。某化学小组模拟该方法回收铜并制取胆矾,流程简图如下:回答下列问题: (1)反应Ⅰ是将Cu转化为Cu(NH3)42+,NH4Cl溶液主要作用是防止由于溶液中c(OH-)过高,生成__________(填化学式),影响铜的回收率。 (2)反应Ⅱ是铜氨溶液中的Cu(NH3)42+与有机物RH反应,操作2的名称是__________,操作2的主要其目的是(填序号)__________。 a.富集铜元素 b.增加Cu2+在水中的溶解度 c.使铜元素与水溶液中的物质分离 (3)反应Ⅲ的化学方程式为_______,若操作③使用下图装置,图中存在的错误有_______处。  (4)操作④由硫酸铜溶液制胆矾的主要步骤是__________过滤、洗涤、干燥。 (5)流程中可循环使用的试剂除了NH3和NH4Cl溶液以外,还有______________。 |
|
| 11. 实验题 | 详细信息 |
Pbl2是生产新型敏化太阳能电池的敏化剂——甲胺铅碘的原料。合成Pbl2的实验流程如图 (1)将铅块制成铅花的目的是______________________________。 (2)①制备硝酸铅时,需要加热,但温度不宜过高,原因是______________________________。 ②31.05g铅花用4.00 mol·L-1的硝酸溶解,化学方程式________________________________,至少需消耗4.00 mol·L-1硝酸__________mL。 (3)取一定质量(CH3COO)2Pb·nH2O样品在N2气氛中在__________(填仪器名称)中加热,测得样品固体残留率( (4)称取一定质量的PhI2固体,用蒸馏水配制成室温时的饱和溶液,准确移取25.00mLPbl2饱和溶液分次加入阳离子交换树脂RH中,发生:2RH(s)+Pb2+(aq)=R2Pb(s)+2H+(aq),用锥形瓶接收流出液,最后用蒸馏水淋洗树脂至流出液呈中性,将洗涤液合并到锥形瓶中。加入2~3滴酚酞溶液,用0.002500 mol·L-1NaOH溶液滴定,到滴定终点时用去氢氧化钠标准溶液20.00 mL。计算室温时PbI2的Ksp=__________。(保留4位有效数字) |
|
最近更新



