2018至2019年高一下册期中考试化学题带答案和解析(云南省昆明市官渡区第一中学)
| 1. 选择题 | 详细信息 |
|
下列化学用语表示正确的是 A. N2的电子式: C. 原子核内有8个中子的氧原子:18O D. S2-的结构示意图: |
|
| 2. 选择题 | 详细信息 |
|
下列表述不正确的是( ) A.人造刚玉熔点很高,可用作高级耐火材料,主要成分是Al2O3 B.硅是制造太阳能电池的常用材料 C.四氧化三铁俗称铁红,可用于作油漆、红色涂料 D.分散系中分散质粒子的直径:Fe(OH)3 悬浊液>Fe(OH)3 胶体>FeCl3 溶液 |
|
| 3. 选择题 | 详细信息 |
|
下列叙述中,正确的是 A. O2、O3互为同位素 B. 1H、2H、3H是三种核素 C. 32He和42He互为同素异形体 D. H2O与D2O的组成元素不同 |
|
| 4. 选择题 | 详细信息 |
|
下列物质中含有共价键的离子化合物是( ) ①MgF2 ②Na2O2 ③KOH ④CO2 ⑤NaClO ⑥H2SO4 ⑦NH3·H2O A. ②③⑤ B. ②③④⑤ C. ①②③⑤ D. ①③⑤⑥ |
|
| 5. 选择题 | 详细信息 |
|
下列对元素周期表说法不正确的是 A. 共有7个周期和16个族 B. 在过渡元素中可以寻找各种优良的催化剂 C. 如果已知元素的最外层电子数为2,由此不能确定该元素在周期表中的位置 D. 目前已知发现的第ⅣA族元素为5种,所以该族元素共有5种单质 |
|
| 6. 选择题 | 详细信息 |
|
下列溶液中的离子—定能大量共存的是 A. 含大量 MnO4-的溶液中:Na+、K+、Cu2+、Fe3+ B. 在加入铝粉能产生氢气的溶液中:NH4+、Fe2+、SO42-、NO3- C. 酸性溶液中:Ba2+、NO3-、K+、AlO2- D. 含大量 Fe3+的溶液中:NH4+、Na+、I-、SCN- |
|
| 7. 选择题 | 详细信息 | |||||||||||||||
下表给出了X、Y、Z、W四种短周期元素的部分信息,请根据这些信息判断下列说法中正确的是
|
||||||||||||||||
| 8. 选择题 | 详细信息 |
|
通过一步反应不能直接完成的是 ①N2→NO2 ②NO2→NO ③NH3→NO ④NO→HNO3 ⑤Cu→Cu(NO3)2 ⑥HNO3→NO2 A. ①⑤ B. ① C. ①④⑥ D. ①④ |
|
| 9. 选择题 | 详细信息 | |||||||||||||||
除去下列物质中混有的少量杂质(括号内为杂质),所用试剂或方法错误的是
|
||||||||||||||||
| 10. 选择题 | 详细信息 |
下列反应中,符合下图所示能量变化的氧化还原反应是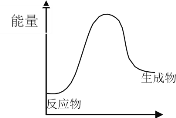 A. Ba(OH)2·8H2O 与NH4Cl固体混合 B. 盐酸与氢氧化钠的反应 C. 高温条件下碳粉与二氧化碳的反应 D. 高温条件下铝与氧化铁的铝热反应 |
|
| 11. 选择题 | 详细信息 |
|
下列变化中,不需要破坏化学键的是( ) A. 氯化氢溶于水 B. 加热碘化氢气体使其分解 C. 冰融化 D. 加热纯碱晶体使之熔化 |
|
| 12. 选择题 | 详细信息 |
短周期元素X、Y、Z在周期表中的位置如图所示,则下列说法正确的是 A. Z一定是活泼的金属 B. Y的最高价氧化物的水化物是一种强酸 C. Z的最高价氧化物的水化物是强酸 D. 1 molY单质跟足量水反应时,有1 mol电子发生转移 |
|
| 13. 选择题 | 详细信息 |
|
为了说明影响化学反应快慢的因素,甲、乙、丙、丁四位学生分别设计了如下A~D四个实验,你认为结论不正确的是 A. 在相同条件下,等质量的大理石块和大理石粉与相同的盐酸反应,大理石粉反应快 B. 将相同大小、形状的镁条和铝条分别与相同浓度的盐酸反应时,两者速率一样大 C. 将浓硝酸分别放在冷暗处和强光照射下,会发现光照可以加快浓硝酸的分解 D. 两支试管中分别加入相同浓度相同体积的双氧水,其中一支试管中再加入几滴氯化铁溶液,产生氧气的快慢不同 |
|
| 14. 选择题 | 详细信息 |
某固体酸燃料电池以CsHSO4固体为电解质传递H+,其基本结构见下图,电池总反应可表示为:2H2+O2=2H2O,下列有关说法正确的是 A. 电子通过外电路从b极流向a极 B. b极上的电极反应式为:O2+2H2O+4e--=4OH-- C. 每转移0.1mol电子,消耗1.12L的H2 D. H+由a极通过固体酸电解质传递到b极 |
|
| 15. 选择题 | 详细信息 |
|
在密闭容器中进行的反应:N2+3H2⇌2NH3(正反应为放热反应),下列说法正确的是 A. 降低温度能加快逆反应速率 B. 保持体积不变,充入N2,能加快反应速率 C. 达到平衡时,反应速率:v(正)=v(逆)=0 D. 达到平衡时,N2和H2能100%转化为NH3 |
|
| 16. 选择题 | 详细信息 |
|
一定温度下,在恒容密闭容器中进行可逆反应2NO2(g) ⇌2NO(g) + O2(g),下列可以作为反应达到化学平衡状态标志的有:①单位时间内生成n mol O2的同时生成n mol NO2;②单位时间内生成n mol O2的同时生成2n mol NO;③NO2、NO、O2的物质的量之比为2:2:1的状态;④密闭容器中压强不再改变的状态;⑤混合气体的颜色不再改变的状态;⑥密闭容器中气体的密度不再改变的状态 A. ①④⑤ B. ③④⑤ C. ④⑤ D. ④⑤⑥ |
|
| 17. 选择题 | 详细信息 |
|
等质量的两份锌粉a和b,分别加入过量的稀硫酸中,a中同时加入少量CuSO4溶液,下列图中表示其产生H2的总体积(V)与时间(t)的关系正确的是( ) A. 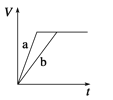 B. B. 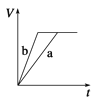 C.  D. D.  |
|
| 18. 选择题 | 详细信息 |
|
把A、B、C、D四块金属片浸泡在稀硫酸中,用导线两两连接可以组成各种原电池。A、B连接时,A 为负极;C、D连接时,电流由D到C;A、C连接时,C极产生大量气饱;B、D连接时,B极上产生大量气泡。则这4种金属的活动生顺序(由强到弱)为( ) A. A>B>C>D B. A>C>D>B C. C>A>B>D D. B>D>C>A |
|
| 19. 选择题 | 详细信息 |
|
设NA表示阿伏加德罗常数的值,下列说法正确的是( ) A. 1L 0.1 mol/L氨水中含有0.1NA NH3分子 B. 46g NO2和N2O4混合气体中含有的原子数为3NA C. 1mol Na2O2中含有的阴离子数为2NA D. 常温常压下,12g 14C所含原子数为NA |
|
| 20. 选择题 | 详细信息 |
|
在探究SO2水溶液成分和性质的实验中,下列根据实验现象得出的结论正确的是 A.向SO2水溶液中加入少量NaHCO3粉末,有气泡产生,说明SO2水溶液呈酸性 B.向SO2水溶液中滴加Ba(NO3)2溶液,有白色沉淀产生,说明SO2水溶液中含有SO42— C.将SO2水溶液中通入H2S气体,有淡黄色沉淀产生,说明SO2水溶液具有氧化性 D.向KMnO4溶液中滴加SO2水溶液,溶液颜色褪去,说明SO2水溶液具有漂白性 |
|
| 21. 选择题 | 详细信息 |
|
下列离子反应方程式正确的是 A. 向氯化铵溶液中加入浓NaOH并加热:NH4+ + OH- B. 碳与浓硝酸反应: C + 4H+ + 2NO3- =CO2 + 2NO↑ + 2H2O C. 氨水与FeCl3反应:3OH- + Fe3+ =Fe(OH)3↓ D. 向NH4Al(SO4)2溶液中滴入Ba(OH)2使SO42-恰好完全反应:2Ba2++4OH-+Al3++2SO42-=BaSO4↓+AlO2-+2H2O |
|
| 22. 选择题 | 详细信息 |
|
高铁酸钠(Na2FeO4)是一种高效的饮用水处理剂。可由下列方法制得:2Fe(OH)3+3NaClO+4NaOH=2Na2FeO4+ 3NaCl+ 5H2O,于该反应说法正确的是 A. Fe(OH)3 中铁元素化合价为+3,只有氧化性 B. 反应中NaClO是氧化剂,NaCl 是氧化产物 C. 生成 lmol Na2FeO4,有6mol电子转移 D. Na2FeO4具有强氧化性,能消毒杀菌 |
|
| 23. 填空题 | 详细信息 |
(1)下列装置属于原电池的是________。 (2)在选出的原电池中,________是负极,发生________反应,________是正极,该极的现象是______________________________。 (3)此原电池反应的化学方程式为_____________________________________________。 |
|
| 24. 填空题 | 详细信息 |
如图所示,把试管放入盛有25 ℃饱和石灰水的烧杯中,试管中开始放入几小块镁条,再滴入5 mL的稀盐酸。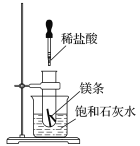 回答下列问题: (1)实验中观察到的现象是____________________________________________。 (2)产生上述现象的原因是_________________________________________________。 (3)写出有关反应的离子方程式_________________________________________。 (4)由实验推知,MgCl2溶液和H2的总能量______(填“大于”、“小于”或“等于”)镁片和盐酸的总能量。 |
|
| 25. 推断题 | 详细信息 |
|
A、B、C、D、E、M、N六种短周期主族元素,它们的核电荷数依次增大。A可与D、E形成10电子分子,其中B的最外层电子数等于次外层电子数,C原子最外层电子数是次外层电子数的2倍,M的L层电子数为K层和M层电子数之和,D和M同主族。回答下列问题: (1)元素B的符号和名称分别是____,______;在周期表中的位置是_________________。 (2)元素C的原子结构示意图为______________________________。 (3)元素C与M可形成CM2,C与N可形成CN4,这两种化合物均可做溶剂,其电子式分别为:________________和____________________。 (4)元素A与D、E形成10电子分子的结构式分别为:_______________和 _________________。 (5)元素D和M相比,非金属性较强的是_____________(用元素符号表示)。 (6)元素D、M的氢化物的沸点高低顺序为:______________________(用化学式表示)。 (7)在一定条件下,A、D的单质和M的最高价氧化物对应水化物的溶液可构成原电池,该电池在放电过程中,电解质溶液的酸性将_____________(填“增大”“减小”或“不变”)。 |
|
| 26. 实验题 | 详细信息 |
纯净干燥的氯气与熔融金属锡反应可制备 SnCl4,某化学小组的同学设计了如下实验装置进行制备。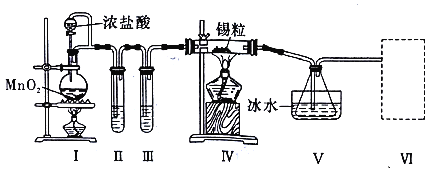 已知:①金属锡熔点为 231℃,化学活泼性与铁相似;②SnCl4 的沸点为 114℃;③SnCl4 易与水反应。 请根据上图装置回答: (1)装置Ⅳ中发生反应的化学方程式为__________________________。 (2)试管II中的试剂是___________________,装置 V 的作用是______________。 (3)裝置Ⅵ最好选用下列装置中的______________________(填标号)。 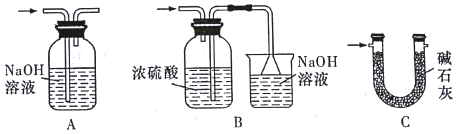 (4)实验结束后,欲回收利用装置Ⅰ中未反应完的 MnO2,需要的分离方法___________。 (5)为了顺利完成实验,点燃酒精灯的正确操作是___________________(填字母)。 A.先点燃 I 处酒精灯,后点燃Ⅳ处酒精灯 B.先点燃Ⅳ处酒精灯,后点燃 I 处酒精灯 C.同时点燃 I、Ⅳ两处酒精灯 |
|
| 27. 综合题 | 详细信息 | ||||||||||||||||||||||||||||||||||||||||||||
|
已知锌与稀盐酸反应放热,某学生为了探究反应过程中的速率变化,用排水集气法收集反应放出的氢气。所用稀盐酸浓度有1.00 mol·L-1、2.00 mol·L-1两种浓度,每次实验稀盐酸的用量为25.00 mL,锌有细颗粒与粗颗粒两种规格,用量为6.50 g。实验温度为298 K、308 K。 (1)完成以下实验设计(填写表格中空白项),并在实验目的一栏中填出对应的实验编号:
|
|||||||||||||||||||||||||||||||||||||||||||||
 .
. 


