福建省三明市第一中学鲁科版高中化学必修一4.1.1 硅及其化合物 练习
| 1. 选择题 | 详细信息 |
|
有些科学家提出硅是“21世纪的能源”,这主要是由于作为半导体材料的硅在太阳能发电过程中具有重要的作用。下列关于硅的说法不正确的是( ) A. 高纯度的单质硅被广泛用于制作计算机芯片 B. 硅可由二氧化硅还原制得 C. 常温时硅与水、空气和酸不反应,但能与氢氟酸反应 D. 自然界硅元素的贮量丰富,并存在大量的单质硅 |
|
| 2. 选择题 | 详细信息 |
|
工业上制取粗硅的反应中,氧化剂与还原剂物质的量之比为 ( ) A. 1:2 B. 2:1 C. 5:3 D. 3:5 |
|
| 3. 选择题 | 详细信息 |
|
硅是一种重要的非金属单质,常温下,下列物质不能与硅发生反应的是 ( ) A. 氢氟酸 B. NaOH溶液 C. F2 D. Cl2 |
|
| 4. 选择题 | 详细信息 |
|
下列溶液能用玻璃瓶盛放,但不能用玻璃塞的是 ( ) A. Na2SO4溶液 B. HF溶液 C. NaOH溶液 D. NaCl溶液 |
|
| 5. 选择题 | 详细信息 |
|
“3G”手机出现后,以光导纤维为基础的高速信息通道尤显重要。下列物质中用于制造光导纤维的材料是 A. 铜合金 B. 陶瓷 C. 硅 D. 二氧化硅 |
|
| 6. 选择题 | 详细信息 |
|
下列关于二氧化硅的说法正确的是 ( ) A. 二氧化硅既能与氢氟酸反应又能与氢氧化钠溶液反应,所以二氧化硅是两性氧化物 B. 二氧化硅分子中含有一个硅原子和两个氧原子 C. 二氧化硅溶于水得到硅酸 D. 纯净的二氧化硅是无色的且熔点高,硬度大。 |
|
| 7. 选择题 | 详细信息 |
|
下列关于硅的说法不正确的是 A. 硅是非金属元素,但它的单质是灰黑色有金属光泽的固体 B. 硅的导电性能介于导体和绝缘体之间,是良好的半导体材料 C. 硅的化学性质不活泼,常温下不与任何物质起反应 D. 当加热到一定程度时,硅能与氧气、氢气等非金属反应 |
|
| 8. 选择题 | 详细信息 |
|
二氧化硅属于酸性氧化物,理由是 A. Si是非金属元素 B. SiO2对应的水化物是可溶性弱酸 C. SiO2与强碱反应生成盐和水 D. SiO2不能与酸反应 |
|
| 9. 填空题 | 详细信息 |
|
硅是无机非金属材料的主角,硅元素的单质及其化合物在环境、能源及材料科学中有着重要影响和广泛应用。试回答下列问题: (1)硅在自然界中最主要的存在形式是_______和_______。 (2)有下列物体或设备:①水晶镜片 ②计算机芯片 ③玛瑙手镯 ④硅太阳能电池 ⑤石英光导纤维。(用序号填写)用到硅单质的是_________;所用材料主要为SiO2的是_________; (3)写出工业上制取粗硅的化学反应方程式___________。其中,氧化剂为_____________,还原剂为_______________。 |
|
| 10. 填空题 | 详细信息 |
| SiO2是____________的酸酐,不溶于水。常温下和NaOH溶液反应的化学方程式为________;碱性试剂不能保存在______塞的试剂瓶中。高温下,SiO2和碱性氧化物(如CaO)反应的化学方程式为:_______;常温下SiO2和氢氟酸反应的化学方程式_______。 | |
| 11. 推断题 | 详细信息 |
A、B、C、D、E代表单质或化合物,它们之间的相互转换关系如下图所示。A为地壳中含量仅次于氧的非金属元素的单质。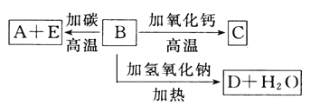 请填空: (1)形成单质A的原子的结构示意图为______,它的最高化合价为______。 (2)B的化学式(分子式)为______,B和碳反应生成A和E的化学方程式是____________。 (3)C的化学式(分子式)为___________,D的化学式(分子式)为_____________。 |
|
| 12. 选择题 | 详细信息 |
|
二氧化硅是一种酸性氧化物,下列物质中不能和二氧化硅发生化学反应的是( ) A. 盐酸 B. 氢氟酸 C. NaOH溶液 D. CaO |
|
| 13. 选择题 | 详细信息 |
|
对于化学方程式SiO2+3C A. 反应中SiO2是氧化剂,C是还原剂 B. 硅元素被还原了,碳元素被氧化了 C. 在反应中C既是氧化剂又是还原剂 D. 在反应中氧化剂与还原剂的物质的量之比为1∶1 |
|
| 14. 选择题 | 详细信息 |
|
下列说法正确的是 ( ) A. 硅材料广泛应用于光纤通讯 B. 工艺师利用盐酸刻蚀石英制作艺术品 C. 水晶项链和餐桌上的瓷盘都是二氧化硅 D. 粗硅制备单晶硅不涉及氧化还原反应 |
|
| 15. 选择题 | 详细信息 |
|
地壳里含量占第一、第二位元素之间形成的化合物不具有的性质是( ) A. 熔点高,硬度大 B. 常温下能与烧碱溶液反应 C. 高温下能与生石灰反应 D. 能与水蒸气反应生成酸 |
|
| 16. 选择题 | 详细信息 |
|
下列物质中在一定条件下能与SiO2起反应的是 ( ) ①浓H2SO4;②H2O;③浓硝酸;④氢氟酸;⑤KOH溶液;⑥氧化钙;⑦碳酸钠 A. ①②⑥ B. ②④ C. ④⑤⑥⑦ D. ③④⑤⑥ |
|
| 17. 填空题 | 详细信息 |
|
硅单质及其化合物应用范围很广,请回答下列问题: 制备硅半导体材料必须先得到高纯硅,三氯甲硅烷(SiHCl3)还原法是当前制备高纯硅的主要方法,生产过程示意图如下: (1)写出由纯SiHCl3制备高纯硅的化学反应方程式___________; (2)整个制备过程必须严格控制无水无氧,SiHCl3遇水剧烈反应生成H2SiO3,HCl和另一种物质,写出配平的化学反应方程式___________; H2还原SiHCl3过程中若混入O2,可能引起的后果是_________。 |
|
| 18. 综合题 | 详细信息 |
已知CO和H2的混合气体称为水煤气,可由碳与水蒸气在高温下反应生成。如下图: 已知:单质E可作为半导体材料,化合物F是有毒的氧化物,C常温下为液态。据此,请填空:(用化学式回答) (1)氧化物A是_____________ (2)化合物F是___________ (3)反应②的化学方程式是_____________________________________ (4)反应③的化学方程式是_____________________________________ |
|
高中化学 试卷推荐
- 高中化学人教版 选修四 第三章 水溶液中的离子反应 第二节 水的电离和溶液的酸碱性 水的电离和溶液的酸碱性第二课时
- 2016-2017年高一上册化学期中考试考卷带参考答案和解析(山东省淄博市淄川一中)
- 2017-2018年高二上期第二次月考化学在线测验(陕西省西安市长安区第一中学)
- 2017-2018年人教版高二化学 选修五 第二章 烃和卤代烃
- 2016-2017年高一上期化学期中考试考试题(辽宁省大连二十中)
- 2017-2018年高二上学期期中考试化学在线测验(宁夏育才中学)
- 2017-2018年高一12月月考化学在线测验(辽宁省大石桥市第二高级中学)
- 2016-2017年高二上学期期中考试化学考试题(辽宁省抚顺市第十九中学)
最近更新



