2018年至2019年高一上期期中联考化学考题(浙江省温州市“十五校联合体”)
| 1. 选择题 | 详细信息 |
|
下列属于酸式盐的是 A. NH4Cl B. NaHCO3 C. H2O2 D. NaH |
|
| 2. 选择题 | 详细信息 |
|
下列变化是氧化还原反应的是( ) A. NH4HCO3 C. 2O3 |
|
| 3. 选择题 | 详细信息 |
|
下列说法不正确的是( ) A. 物质的量是研究物质所含微粒集体的多少,单位为mol B. 物质的量把微观粒子数目与宏观物质的质量联系起来 C. 1mol NaCl 晶体中含有NA个NaCl分子 D. 0.012kg C-12中所含的原子数为阿佛加德罗常数,NA近似为6.02x1023mol-1 |
|
| 4. 选择题 | 详细信息 |
|
已知a g CH4中含有b个H原子,则NA为 A. 4b/a B. b/a C. 16b/a D. a/4b |
|
| 5. 选择题 | 详细信息 |
|
下列说法正确的是 A. 1mol 固体或液体的体积主要由微粒间距离决定 B. 1mol气体的体积主要由微粒的大小决定 C. O2的气体摩尔体积约为22.4L·mol-1 D. 气体微粒间的距离受温度压强影响大,固体或液态微粒间的距离受温度压强影响小 |
|
| 6. 选择题 | 详细信息 |
|
下列关于胶体的描述不正确的是 A. 胶体分散质粒子直径在1-100nm之间 B. 胶体具有丁达尔现象 C. Fe(OH)3胶体具有净水作用 D. 胶体是不透明,但均一,相对稳定的分散系 |
|
| 7. 选择题 | 详细信息 |
|
下列说法正确的是 A. HCl溶于水后形成水合氢离子和水合氯离子 B. HCl溶于水或融熔状态下均能导电 C. 盐酸是电解质,酒精为非电解质 D. 盐酸属于无氧酸,H2SO4属于含氧酸 |
|
| 8. 选择题 | 详细信息 |
|
下列电离方程式正确的是 A. CaCl2=Ca2++Cl2- B. CH3CH2OH(乙醇)=CH3CH2O- +H+ C. NaHSO4=Na++H++SO42- D. KMnO4=K++Mn2++4O2- |
|
| 9. 选择题 | 详细信息 |
|
下列关于物质分离提纯的描述不正确的是( ) A. 物质分离或提纯方法的选择依据是混合物的状态和性质 B. KCl和MnO2混合物分离步骤为:溶于水、过滤、洗涤、干燥、蒸发、结晶 C. 从碘水中萃取I2,可选择用苯、乙醇、四氯化碳作萃取剂 D. NaCl中混有少量KNO3杂质,分离步骤为溶于水、蒸发结晶、趁热过滤、洗涤、干燥 |
|
| 10. 选择题 | 详细信息 |
|
下列实验操作正确的是( ) A. 用蒸发皿蒸发溶液时,应垫石棉网 B. 使用分液漏斗前无需检漏 C. 萃取时,分液漏斗倒转,不断振荡,并及时放气 D. 分液时,上层液体等下层液放出后,再继续放出 |
|
| 11. 选择题 | 详细信息 |
|
下列仪器可用于物质的分离提纯的是( ) ①蒸发皿 ②漏斗 ③分液漏斗 ④表面皿 ⑤研钵 ⑥蒸馏烧瓶 ⑦托盘天平 ⑧洗气瓶 A. ②③④⑥⑧ B. ①②③⑥⑧ C. ①③⑥⑧ D. ③⑤⑥⑦⑧ |
|
| 12. 选择题 | 详细信息 |
|
下列说法不正确的是 A. 焰色反应体现了元素的物理性质 B. 用盐酸酸化的BaCl2溶液检验待测溶液中是否存在SO42- C. 有色玻璃是某些胶态金属氧化物分散到玻璃中制成 D. 用原子吸收光谱确定物质中含有哪些金属元素 |
|
| 13. 选择题 | 详细信息 |
|
下列说法正确的是( ) A. 物质的量浓度是指单位体积溶剂中所含溶质的物质的量 B. 容量瓶不能作反应的容器,但可以储存配好的溶液 C. 容量瓶使用前要检漏,方法是加入一定量水倒转过来不漏即可 D. 定容时,往容量瓶中注入蒸馏水,直到液面接近容量瓶的刻度线1—2厘米处时,改用胶头滴管滴加,直到溶液凹液面正好与刻度线相切 |
|
| 14. 选择题 | 详细信息 |
|
下列说法不正确的是 A. 原子结构模型的演变为:希腊哲学家提出原子概念→ 道尔顿原子学说 → 汤姆生葡萄干面包式 → 卢瑟福带核原子模型 → 玻尔电子轨道理论 → 量子力学 B. 人类对原子结构的认识过程,启示了微观结构也要通过实验验证,同时要付出很大心血 C. 在原子结构分层排布中,M层(第三层)容纳电子数最多为18,最少为8 D. 在化学反应过程中,原子核不发生变化,但原子外层电子可能发生变化 |
|
| 15. 选择题 | 详细信息 |
|
下列说法不正确的是 A. 质量数是将原子核内所有的质子和中子的相对质量取整数值之和 B. AZX表示一种X元素的一种原子,中子数为A-Z C. AZX中,A为该原子的相对原子质量的近似值 D. 原子都是质子和中子、电子组成,原子不带电 |
|
| 16. 选择题 | 详细信息 |
|
若612C原子的质量为a g,A原子的质量为b g,NA为阿伏加德罗常数,则A元素的相对原子质量为 A. 12 a/b B. 12 b/a C. aNA D. 不能确定 |
|
| 17. 选择题 | 详细信息 |
|
下列说法不正确的是( ) A. 14C的放射性可用于考古判断年代 B. 1H2、2H2、3H2互为同位素 C. 1molT2O中含中子数为12NA D. 氢有三种同位素,氧有三种同位素,组成的水分子有18种 |
|
| 18. 选择题 | 详细信息 |
|
下列说法不正确的是 A. I- 遇淀粉变蓝色,I2易升华 B. 常温下单质溴为深红棕色液体,溴元素被称为海洋元素 C. 海水制溴,溶于水的溴可鼓入热空气或水蒸气吹出来 D. AgBr是重要的感光材料,AgI 可用于人工降雨 |
|
| 19. 选择题 | 详细信息 |
电解饱和食盐水,2NaCl+2H2O 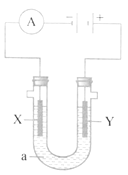 A. 在X极生成2mol Cl2 B. 在X极生成2molH2 C. 在Y极生成4mol Cl2 D. NaOH在Y极生成 |
|
| 20. 选择题 | 详细信息 |
|
下列说法不正确的是 A. 新制氯水具有漂白性,与活性炭的漂白原理相同 B. HClO是一种弱酸,酸性比碳酸弱 C. HClO见光、加热易分解,放出O2 D. 新制氯水存在Cl2、HClO、H2O分子,H+、Cl-、ClO-、OH- 离子 |
|
| 21. 选择题 | 详细信息 |
|
在相同温度和压强下,容器A中的臭氧(O3)和容器B中的乙炔气(C2H2)所含的分子个数相同,则A、B两容器中气体的体积之比是( ) A. 4:3 B. 3:4 C. 1:1 D. 2:3 |
|
| 22. 选择题 | 详细信息 |
|
氯化钠中含有少量硫酸镁、氯化钙和泥沙等杂质,需进行下列项操作:①加水溶解 ② 加入过量的氯化钡溶液 ③加热蒸发得到晶体 ④加入过量碳酸钠和氢氧化钠 ⑤ 加入适量的盐酸⑥过滤 下列操作顺序正确的是( ) A. ①②④③⑥⑤ B. ①②④⑥⑤③ C. ①④⑤⑥③② D. ①④②⑤⑥③ |
|
| 23. 选择题 | 详细信息 |
|
判断下列有关化学基本概念的依据不正确的是 A. 氧化还原反应:元素化合价前后是否有变化 B. 溶液与胶体:不同的本质是分散质粒子的直径 C. 电解质与非电解质:化合物本身是否能导电 D. 纯净物与混合物:是否仅含有一种物质 |
|
| 24. 选择题 | 详细信息 |
|
NA为阿伏加德罗常数,下列叙述正确的是 A. 标准状况下,4.48L乙醇含分子为0.2NA B. 13g C-13含有的碳原子数为NA C. 32g O3所含有的电子数为16NA D. 2.4g Mg与足量盐酸反应转移电子数0.1NA |
|
| 25. 选择题 | 详细信息 |
|
由四种金属Zn、Fe、Mg、Al组成的混合物10g,与足量的盐酸反应产生的H2,在标准状况下的体积为11.2L,则混和物中一定存在的金属是 A. Zn B. Fe C. Mg D. Al |
|
| 26. 填空题 | 详细信息 |
|
(1)下列物质中含原子数最多的是________(填序号,下同)。 ①9g H2O ②3.01×1023个CH4分子 ③0.3mol NH3 ④11.2L CO2(标况) (2)下列物质中属于电解质的是_________。 ①盐酸 ② Fe ③ 熔融NaCl ④ 蔗糖 ⑤KNO3晶体 ⑥Na2SO4溶液 (3)除去KNO3固体中少量的KCl,选择正确的操作并排序___________________。 ①过滤 ②萃取 ③固体溶于水 ④冷却结晶 ⑤蒸发浓缩 ⑥干燥 ⑦洗涤 ⑧分液 |
|
| 27. 实验题 | 详细信息 |
|
固体粉末可能含有:NH4Cl、K2CO3、Ba(NO3)2、CuCl2、Na2SO4、Na2CO3中的一种或几种,实验如下: ①将固体粉末溶于水,得无色溶液和白色沉淀 ②将①得到的溶液加入AgNO3溶液产生白色沉淀 ③将①得到的溶液加入浓NaOH溶液并加热,产生刺激性的气体遇湿润的红色石蕊试纸变蓝 ④将①滤出的白色沉淀加入稀盐酸,沉淀部分溶解,并产生气体 则 (1)关于Na2CO3、K2CO3的存在说法正确的是(_____)。 A. 两者一定存在 B. 两者可能都不存在 C. 两者可能同时存在 D. 若无K2CO3,必然存在Na2CO3;若有K2CO3,不能确定Na2CO3的存在 (2)检验是否存在K2CO3的具体操作是_____________________ |
|
| 28. 实验题 | 详细信息 |
|
为配制480mL0.1mol·L-1Na2SO4溶液。回答下列问题。 (1)应用托盘天平称取十水硫酸钠(Na2SO4·10H2O)晶体________g。 (2)配制Na2SO4溶液时需用的主要仪器有托盘天平、药匙、烧杯、玻璃棒、_____________________、_______________________________。 (3)实验时遇下列情况,溶液的浓度偏低的是_________________。 A.溶解后没有冷却便进行定容 B.忘记将洗涤液转入容量瓶 C.容量瓶内壁附有水珠而未干燥处理 D.称量的硫酸钠晶体部分失水 E.加水定容时越过刻度线 F.俯视刻度线定容 |
|
| 29. 实验题 | 详细信息 |
用海带制备单质碘,制备过程如下: 已知:常温下,碘在水中的溶解度为0.034g;碘的沸点为184℃;CCl4的沸点为77℃。  请回答: (1)A物质是__________。 (2)写出在酸化下用H2O2氧化NaI的化学反应方程式_________________。 (3)流程中省略部分的操作是_____________。 (4)蒸馏装置中错误的是__________________(写三条)。 (5)蒸馏出的CCl4液体中常会带淡紫色,可能的原因是______________ |
|
| 30. 实验题 | 详细信息 |
实验室制备Cl2和新制的Cl2水,如图所示: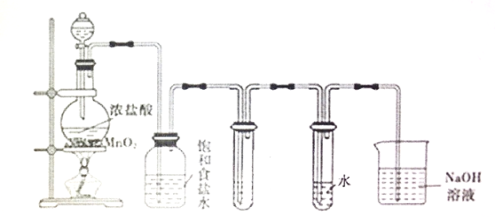 (1)装置中若无盛饱和食盐水的洗气瓶,将导致____________________。 (2)要证明Cl2与水反应是可逆反应,则证明Cl2水存在Cl2分子的现象是________,证明同时存在HCl和HClO的实验操作是_____________________。 (3)吸收Cl2尾气的化学反应方程式为________________________。 (4)用KClO3代替MnO2,不需加热就可以快速制得Cl2,该反应化学方程式为_____________________。 (5)有一种含氯氧化物,含氧量18.4%,与水反应,生成HClO,该氧化物的化学式是___________________,它属于___________。 A. 酸性氧化物 B. 碱性氧化物 C. 酸酐 D.氯化物 (6)新制氯水中加入少量Na2CO3溶液有气体产生,该反应的化学方程式为_____ |
|
| 31. 计算题 | 详细信息 |
|
在标准状况下,0.200L的某气体的质量为0.250g,该气体为双原子分子,2.80L该标准状况下的气体完全燃烧后生成的气体通入足量的澄清石灰水生成白色沉淀,求: (1)该气体的摩尔质量是___________。 (2)生成白色沉淀的质量为________。 |
|
| 32. 计算题 | 详细信息 |
|
在一定温度下,Cl2通入到1L 0.7 mol·L-1的NaOH溶液中,恰好生成NaCl、NaClO、NaClO3,其中生成NaCl和NaClO的物质的量之比为11:1,求: (1)生成NaClO3的物质的量是___________。 (2)通入的Cl2在标准状况下的体积____________。 |
|
高中化学 试卷推荐
- 高中化学人教版 选修五 第五章 第三节 功能高分子材料
- 2018年至2019年高二上期9月月考化学试卷完整版(黑龙江省齐齐哈尔市第八中学)
- 2017-2018年高一12月月考化学考试(湖北省宜昌市长阳县第一高级中学)
- 2016-2017年高一上册化学期中考试试卷(江苏省连云港市锦屏高级中学)
- 湖北高二化学月考测验(2019年上学期)带答案与解析
- 高中化学人教版 选修四 第三章 水溶液中的离子反应 第二节 水的电离和溶液的酸碱性 水的电离和溶液的酸碱性第一课时
- 2018届高三第二次联考理综化学在线测验(安徽省皖南八校)
- 2017-2018年高二上学期11月第一次验收考试化学在线测验(黑龙江省哈尔滨三中)
最近更新



