жІӘ科зүҲеҢ–еӯҰжӢ“еұ•жҖ§иҜҫзЁӢ1гҖҠеҺҹеӯҗз»“жһ„дёҺе…ғзҙ е‘ЁжңҹеҫӢгҖӢжөӢиҜ•еҚ·еёҰеҸӮиҖғзӯ”жЎҲе’Ңи§Јжһҗ
| 1. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—иЎЁиҫҫж–№ејҸжӯЈзЎ®зҡ„жҳҜ A. Asзҡ„з”өеӯҗжҺ’еёғејҸпјҡ[Ar]4s24p3 B. Nзҡ„д»·з”өеӯҗжҺ’еёғеӣҫ C. CrеҺҹеӯҗз»“жһ„зӨәж„Ҹеӣҫ 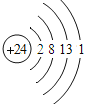 D. Fe2+зҡ„д»·з”өеӯҗжҺ’еёғејҸдёәпјҡ[Ar]3d54s1 |
|
| 2. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—еҸҷиҝ°жӯЈзЎ®зҡ„жҳҜ A.еҚӨзҙ еҚ•иҙЁзҡ„йўңиүІйҡҸж ёз”өиҚ·ж•°зҡ„еўһеӨ§иҖҢйҖҗжёҗеҠ ж·ұ B.еҚӨзҙ еҪўжҲҗзҡ„ж°ўеҢ–зү©зЁіе®ҡжҖ§йҡҸж ёз”өиҚ·ж•°еўһеӨ§иҖҢеўһеӨ§ C.зўұйҮ‘еұһйғҪжҜ”ж°ҙиҪ» D.зўұйҮ‘еұһйғҪдҝқеӯҳеңЁз…ӨжІ№дёӯ |
|
| 3. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—иҜҙжі•дёӯжӯЈзЎ®зҡ„жҳҜ A. з”өеӯҗдә‘йҖҡеёёжҳҜз”Ёе°Ҹй»‘зӮ№жқҘиЎЁзӨәз”өеӯҗзҡ„еӨҡе°‘ B. еңЁеҗҢдёҖиғҪзә§дёҠиҝҗеҠЁзҡ„з”өеӯҗпјҢе…¶иҝҗеҠЁзҠ¶жҖҒжҳҜзӣёеҗҢзҡ„ C. иғҪеұӮеәҸж•°и¶ҠеӨ§пјҢsз”өеӯҗдә‘зҡ„еҚҠеҫ„и¶ҠеӨ§ D. з”өеӯҗд»…еңЁжҝҖеҸ‘жҖҒи·ғиҝҒеҲ°еҹәжҖҒж—¶жүҚдјҡдә§з”ҹеҺҹеӯҗе…үи°ұ |
|
| 4. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
е…ідәҺй”ӮгҖҒй’ гҖҒй’ҫгҖҒй“·гҖҒй“Ҝзҡ„дёӢеҲ—еҸҷиҝ°дёӯжӯЈзЎ®зҡ„жҳҜпјҲ пјү A. е…¶ж°ўж°§еҢ–зү©дёӯзўұжҖ§жңҖејәзҡ„жҳҜж°ўж°§еҢ–й”Ӯ B. зҰ»еӯҗзҡ„ж°§еҢ–иғҪеҠӣжңҖејәзҡ„жҳҜй“ҜзҰ»еӯҗ C. еҺҹеӯҗеҚҠеҫ„йҡҸж ёз”өиҚ·ж•°зҡ„еўһеҠ иҖҢеўһеӨ§ D. еҚ•иҙЁзҡ„еҜҶеәҰйғҪжҜ”ж°ҙзҡ„еҜҶеәҰе°Ҹ |
|
| 5. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
еӨ©з„¶еӯҳеңЁзҡ„йҮ‘еұһй’«пјҲFrпјүжһҒеҫ®йҮҸгҖӮе®ғзҡ„21дёӘе·ІзҹҘеҗҢдҪҚзҙ йғҪжңүж”ҫе°„жҖ§гҖӮе®ғжҳҜзўұйҮ‘еұһе…ғзҙ дёӯжңҖйҮҚзҡ„е…ғзҙ ,ж №жҚ®е®ғеңЁе‘ЁжңҹиЎЁдёӯзҡ„дҪҚзҪ®йў„иЁҖе…¶жҖ§иҙЁ,е…¶дёӯдёҚжӯЈзЎ®зҡ„жҳҜпјҲ пјү A.еңЁе·ІзҹҘе…ғзҙ дёӯе…·жңүжңҖеӨ§зҡ„еҺҹеӯҗеҚҠеҫ„ B.еңЁз©әж°”дёӯзҮғзғ§ж—¶еҸӘз”ҹжҲҗж°§еҢ–зү©Fr2O C.ж°§еҢ–зү©еҜ№еә”зҡ„ж°ҙеҢ–зү©жҳҜжһҒејәзҡ„зўұ D.е…¶еҚ•иҙЁеёёжё©дёӢи·ҹж°ҙеҸҚеә”жҜ”й’ еү§зғҲ |
|
| 6. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—иЎЁиҫҫж–№ејҸжӯЈзЎ®зҡ„жҳҜ A.Crзҡ„еӨ–еӣҙз”өеӯҗжҺ’еёғејҸпјҡ3d44s2 B.NaHCO3еңЁж°ҙдёӯзҡ„з”өзҰ»ж–№зЁӢејҸпјҡNaHCO3=Na++H++CO32- C.еҹәжҖҒзўіеҺҹеӯҗзҡ„д»·з”өеӯҗжҺ’еёғеӣҫдёәпјҡ D.дәҢж°§еҢ–зЎ…зҡ„еҲҶеӯҗејҸдёәSiO2 |
|
| 7. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—иҜҙжі•дёҚжӯЈзЎ®зҡ„жҳҜ(гҖҖгҖҖ) A. жІёзӮ№пјҡH2OпјһHF B. NCl3гҖҒSiCl4еҲҶеӯҗдёӯжҜҸдёӘеҺҹеӯҗжңҖеӨ–еұӮеқҮж»Ўи¶і8з”өеӯҗз»“жһ„ C. зғӯзЁіе®ҡжҖ§пјҡHFпјһH2O D. д»…з”ұNгҖҒHгҖҒOдёүз§Қе…ғзҙ еҪўжҲҗзҡ„еҢ–еҗҲзү©дёӯдёҚеҸҜиғҪеҗ«зҰ»еӯҗй”® |
|
| 8. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
XгҖҒYгҖҒZгҖҒWеқҮдёәзҹӯе‘Ёжңҹе…ғзҙ дё”еҺҹеӯҗеәҸж•°дҫқж¬ЎеўһеӨ§пјҢе…¶дёӯYгҖҒWеҗҢдё»ж—Ҹпјӣеёёжё©дёӢпјҢYгҖҒWзҡ„еҚ•иҙЁдёәжңүиүІж°”дҪ“пјҢ Wж°”дҪ“еҗҢеҶ·зғ§зўұжә¶ж¶ІдҪңз”ЁпјҢеҸҜеҫ—еҲ°еҗ«ZWXзҡ„зӣҗжә¶ж¶ІпјҺдёӢеҲ—иҜҙжі•дёӯжӯЈзЎ®зҡ„жҳҜпјҲгҖҖгҖҖпјү A. Z2X2 дёӯйҳҙйҳізҰ»еӯҗдёӘж•°жҜ”дёә1:1 B. е…ғзҙ Xе’ҢWзҡ„жҹҗдәӣеҚ•иҙЁеҸҜдҪңдёәж°ҙеӨ„зҗҶдёӯзҡ„ж¶ҲжҜ’еүӮ C. еҺҹеӯҗеҚҠеҫ„еӨ§е°ҸдёәX<Y<Z<W D. Yзҡ„ж°ўеҢ–зү©ж°ҙжә¶ж¶Ій…ёжҖ§ејәдәҺWзҡ„ |
|
| 9. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
дёҺж°–ж ёеӨ–з”өеӯҗжҺ’еёғзӣёеҗҢзҡ„зҰ»еӯҗе’ҢдёҺж°©ж ёеӨ–з”өеӯҗжҺ’еёғзӣёеҗҢзҡ„зҰ»еӯҗжүҖеҪўжҲҗзҡ„еҢ–еҗҲзү©зҡ„пјҲ пјү A. MgBr2 B. Al2O3 C. KF D. .K2S |
|
| 10. | иҜҰз»ҶдҝЎжҒҜ | |||||||||||||||
дёӢеҲ—дәӢе®һдёҚиғҪиҜҙжҳҺе…ғзҙ зҡ„йҮ‘еұһжҖ§жҲ–йқһйҮ‘еұһжҖ§зӣёеҜ№ејәејұзҡ„жҳҜ
|
||||||||||||||||
| 11. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
еңЁйҖҡеёёжқЎд»¶дёӢпјҢдёӢеҲ—еҗ„з»„зү©иҙЁзҡ„жҖ§иҙЁжҺ’еҲ—жӯЈзЎ®зҡ„жҳҜ( ) A. NaгҖҒMgгҖҒAl зҡ„第дёҖз”өзҰ»иғҪйҖҗжёҗеўһеӨ§ B. зғӯзЁіе®ҡжҖ§пјҡHFпјһH2OпјһNH3 C. S2п№ЈгҖҒClп№ЈгҖҒK+зҡ„еҚҠеҫ„йҖҗжёҗеўһеӨ§ D. OгҖҒFгҖҒN зҡ„з”өиҙҹжҖ§йҖҗжёҗеўһеӨ§ |
|
| 12. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
ж №жҚ®е…ғзҙ е‘ЁжңҹиЎЁе’Ңе‘ЁжңҹеҫӢзӣёе…ізҹҘиҜҶеҲӨж–ӯпјҢдёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜ A. зЎ’пјҲSeпјүе…ғзҙ зҡ„йқһйҮ‘еұһжҖ§жҜ”зЎ«ејә B. Cl-гҖҒK+гҖҒCa2+зҡ„зҰ»еӯҗеҚҠеҫ„жңҖеӨ§зҡ„жҳҜCa2+ C. Sr (OH)2пјҲж°ўж°§еҢ–锶пјүзҡ„зўұжҖ§жҜ”Ca (OH)2ејұ D. BeдёҺAlзҡ„еҢ–еӯҰжҖ§иҙЁзӣёдјјпјҢBeOжҳҜдёӨжҖ§ж°§еҢ–зү© |
|
| 13. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—иЎЁзӨәй’ еҺҹеӯҗзҡ„ејҸеӯҗдёӯиғҪеҸҚжҳ иғҪзә§е·®еҲ«е’Ңз”өеӯҗиҮӘж—ӢзҠ¶жҖҒзҡ„жҳҜпјҲ пјү A. 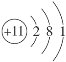 B.23Na B.23NaC.1s22s22p63s1 D. |
|
| 14. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—иЎЁиҫҫж–№ејҸй”ҷиҜҜзҡ„жҳҜпјҲ пјү A. з”Ізғ·зҡ„з”өеӯҗејҸ C. зЎ«зҰ»еӯҗзҡ„ж ёеӨ–з”өеӯҗжҺ’еёғејҸ1s22s22p63s23p6 D. зўіпјҚ12еҺҹеӯҗжһ„жҲҗ |
|
| 15. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
е…ғзҙ е‘ЁжңҹиЎЁдёӯйҮ‘еұһдёҺйқһйҮ‘еұһзҡ„еҲҶз•Ңзәҝйҷ„иҝ‘иғҪжүҫеҲ°пјҲ пјү A. ж–°еҲ¶еҶңиҚҜе…ғзҙ B. еҲ¶еӮ¬еҢ–еүӮе…ғзҙ C. еҲ¶еҚҠеҜјдҪ“е…ғзҙ D. йқһйҮ‘еұһе…ғзҙ |
|
| 16. еЎ«з©әйўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
з”ЁеҢ–еӯҰз”ЁиҜӯеЎ«з©әгҖӮ(1)зҹӯе‘Ёжңҹе…ғзҙ дёӯпјҢйҮ‘еұһжҖ§жңҖејәзҡ„жҳҜ_______пјҢйқһйҮ‘еұһжҖ§жңҖејәзҡ„жҳҜ________пјӣжңҖй«ҳд»·ж°§еҢ–зү©еҜ№еә”зҡ„ж°ҙеҢ–зү©дёӯй…ёжҖ§жңҖејәзҡ„жҳҜ_________пјҢзўұжҖ§жңҖејәзҡ„жҳҜ__________гҖӮ (2)第дёүе‘Ёжңҹе…ғзҙ дёӯпјҢеҺҹеӯҗеҚҠеҫ„жңҖе°Ҹзҡ„жҳҜ___________гҖӮ (3)зўұйҮ‘еұһе…ғзҙ дёӯ(йҷӨ Fr еӨ–)пјҢеҚ•иҙЁеҜҶеәҰжңҖе°Ҹзҡ„жҳҜ_______пјҢзҶ”зӮ№жңҖдҪҺзҡ„жҳҜ_________гҖӮ (4)еҚӨзҙ дёӯйқһйҮ‘еұһжҖ§жңҖејәзҡ„е…ғзҙ еңЁе‘ЁжңҹиЎЁдёӯзҡ„дҪҚзҪ®дёә_________________гҖӮ |
|
| 17. еЎ«з©әйўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
AгҖҒBгҖҒCгҖҒDгҖҒEгҖҒFд»ЈиЎЁ6з§Қе…ғзҙ гҖӮиҜ·еЎ«з©әпјҡ пјҲ1пјүAе…ғзҙ еҹәжҖҒеҺҹеӯҗзҡ„жңҖеӨ–еұӮжңү2дёӘжңӘжҲҗеҜ№з”өеӯҗпјҢж¬ЎеӨ–еұӮжңү2дёӘз”өеӯҗпјҢе…¶е…ғзҙ з¬ҰеҸ·дёә____________пјӣ пјҲ2пјүBе…ғзҙ зҡ„иҙҹдёҖд»·зҰ»еӯҗе’ҢCе…ғзҙ зҡ„жӯЈдёҖд»·зҰ»еӯҗзҡ„з”өеӯҗеұӮз»“жһ„йғҪдёҺж°©зӣёеҗҢпјҢBзҡ„е…ғзҙ з¬ҰеҸ·дёә________пјҢCзҡ„е…ғзҙ з¬ҰеҸ·дёә________пјӣ пјҲ3пјүDе…ғзҙ зҡ„жӯЈдёүд»·зҰ»еӯҗзҡ„3dиғҪзә§дёәеҚҠе……ж»ЎпјҢDзҡ„е…ғзҙ з¬ҰеҸ·дёә_____пјҢе…¶еҹәжҖҒеҺҹеӯҗзҡ„з”өеӯҗжҺ’еёғејҸдёә_______пјӣ пјҲ4пјүEе…ғзҙ еҹәжҖҒеҺҹеӯҗзҡ„MеұӮе…Ёе……ж»ЎпјҢNеұӮжІЎжңүжҲҗеҜ№з”өеӯҗпјҢеҸӘжңүдёҖдёӘжңӘжҲҗеҜ№з”өеӯҗпјҢEзҡ„е…ғзҙ з¬ҰеҸ·дёә________пјҢе…¶еҹәжҖҒеҺҹеӯҗзҡ„з”өеӯҗжҺ’еёғејҸдёә____________гҖӮ пјҲ5пјүFе…ғзҙ зҡ„еҺҹеӯҗжңҖеӨ–еұӮз”өеӯҗжҺ’еёғејҸдёәnsnnpnпјӢ1пјҢеҲҷnпјқ________пјӣеҺҹеӯҗдёӯиғҪйҮҸжңҖй«ҳзҡ„жҳҜ________з”өеӯҗгҖӮ |
|
| 18. еЎ«з©әйўҳ | иҜҰз»ҶдҝЎжҒҜ | ||||||||||||||||
AгҖҒBгҖҒCгҖҒDгҖҒEгҖҒFгҖҒGгҖҒHжҳҜе…ғзҙ е‘ЁжңҹиЎЁеүҚеӣӣе‘Ёжңҹеёёи§Ғе…ғзҙ пјҢдё”еҺҹеӯҗеәҸж•°дҫқж¬ЎеўһеӨ§пјҢе…¶зӣёе…ідҝЎжҒҜеҰӮдёӢиЎЁпјҡ
|
|||||||||||||||||
| 19. еЎ«з©әйўҳ | иҜҰз»ҶдҝЎжҒҜ | ||||||
зҺ°жңүе…ӯз§Қе…ғзҙ пјҢе…¶дёӯAгҖҒBгҖҒCгҖҒDгҖҒEдёәзҹӯе‘Ёжңҹдё»иҰҒж—Ҹе…ғзҙ пјҢFдёә第еӣӣе‘Ёжңҹе…ғзҙ пјҢе®ғ们зҡ„еҺҹеӯҗеәҸж•°дҫқж¬ЎеўһеӨ§гҖӮиҜ·ж №жҚ®дёӢеҲ—зӣёе…ідҝЎжҒҜпјҢеӣһзӯ”й—®йўҳгҖӮ
|
|||||||
| 20. жҺЁж–ӯйўҳ | иҜҰз»ҶдҝЎжҒҜ | ||||||||||||
AгҖҒBгҖҒCгҖҒDгҖҒEжҳҜе‘ЁжңҹиЎЁдёӯеүҚеӣӣе‘Ёжңҹзҡ„е…ғзҙ ,е…¶жңүе…іжҖ§иҙЁжҲ–з»“жһ„дҝЎжҒҜеҰӮдёӢиЎЁ:
|
|||||||||||||
| 21. жҺЁж–ӯйўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
QгҖҒRгҖҒXгҖҒYгҖҒZдёәе‘ЁжңҹиЎЁдёӯеҺҹеӯҗеәҸж•°дҫқж¬ЎйҖ’еўһзҡ„еүҚеӣӣе‘Ёжңҹе…ғзҙ гҖӮ е·ІзҹҘпјҡв‘ Qдёәе…ғзҙ е‘ЁжңҹиЎЁдёӯеҺҹеӯҗеҚҠеҫ„жңҖе°Ҹзҡ„е…ғзҙ пјӣв‘ЎRзҡ„еҹәжҖҒеҺҹеӯҗдёӯз”өеӯҗеҚ жҚ®дёүз§ҚиғҪйҮҸдёҚеҗҢзҡ„иғҪзә§пјҢдё”жҜҸз§ҚиғҪзә§дёӯзҡ„з”өеӯҗжҖ»ж•°зӣёеҗҢпјӣв‘ўYзҡ„еҹәжҖҒеҺҹеӯҗзҡ„ж ёеӨ–жҲҗеҜ№зҡ„з”өеӯҗж•°жҳҜжңӘжҲҗеҜ№зҡ„з”өеӯҗж•°зҡ„3еҖҚпјӣв‘ЈZеҹәжҖҒеҺҹеӯҗжңүе…ӯдёӘжңӘжҲҗеҜ№з”өеӯҗгҖӮз”ЁеҜ№еә”зҡ„е…ғзҙ з¬ҰеҸ·жҲ–еҢ–еӯҰејҸеӣһзӯ”дёӢеҲ—й—®йўҳпјҡ (1)RгҖҒXгҖҒYзҡ„第дёҖз”өзҰ»иғҪз”ұеӨ§еҲ°е°Ҹзҡ„йЎәеәҸдёә____________________гҖӮ (2)Qе…ғзҙ еңЁе…ғзҙ е‘ЁжңҹиЎЁдёӯеұһдәҺ____еҢәпјҢдёҺYе…ғзҙ еҗҢж—Ҹзҡ„第еӣӣе‘Ёжңҹе…ғзҙ зҡ„д»·з”өеӯҗжҺ’еёғејҸдёә______гҖӮ (3)RY2зҡ„з”өеӯҗејҸдёә________________пјҢZ3+зҡ„зҰ»еӯҗз»“жһ„зӨәж„Ҹеӣҫдёә____________гҖӮ (4) з”ұYгҖҒZдёӨз§Қе…ғзҙ з»„жҲҗзҡ„Z2Y72пјҚзҰ»еӯҗеңЁй…ёжҖ§жқЎд»¶дёӢеҸҜдёҺд№ҷйҶҮеҸҚеә”пјҢз”ҹжҲҗд№ҷй…ёгҖҒZ3+зӯүзү©иҙЁгҖӮиҜҘеҸҚеә”зҡ„зҰ»еӯҗж–№зЁӢејҸдёә______гҖӮ |
|
| 22. е®һйӘҢйўҳ | иҜҰз»ҶдҝЎжҒҜ | ||||||||||||
дёӢйқўжҳҜжҹҗеҢ–еӯҰе…ҙи¶Је°Ҹз»„зҡ„еҗҢеӯҰеҒҡеҗҢе‘Ёжңҹе…ғзҙ жҖ§иҙЁйҖ’еҸҳ规еҫӢе®һйӘҢж—¶пјҢи®ҫи®ЎдәҶдёҖеҘ—е®һйӘҢж–№жЎҲгҖӮе…¶дёӯе®һйӘҢжӯҘйӘӨеҰӮдёӢпјҡ
|
|||||||||||||
| 23. е®һйӘҢйўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
жҹҗеҗҢеӯҰдёәжҺўз©¶е…ғзҙ е‘ЁжңҹиЎЁдёӯе…ғзҙ жҖ§иҙЁзҡ„йҖ’еҸҳ规еҫӢпјҢи®ҫи®ЎдәҶеҰӮдёӢзі»еҲ—е®һйӘҢгҖӮ I.пјҲ1пјүе°Ҷй’ гҖҒй’ҫгҖҒй•ҒгҖҒй“қеҗ„1molеҲҶеҲ«жҠ•е…ҘеҲ°и¶ійҮҸзҡ„еҗҢжө“еәҰзҡ„зӣҗй…ёдёӯпјҢиҜ•йў„жөӢе®һйӘҢз»“жһңпјҡ ___дёҺзӣҗй…ёеҸҚеә”жңҖеү§зғҲпјӣ____дёҺзӣҗй…ёеҸҚеә”зҡ„йҖҹеәҰжңҖж…ўпјӣ___дёҺзӣҗй…ёеҸҚеә”дә§з”ҹзҡ„ж°”дҪ“жңҖеӨҡгҖӮ пјҲ2пјүе°ҶNaOHжә¶ж¶ІдёҺNH4Clжә¶ж¶Іж··еҗҲз”ҹжҲҗNH3В·H2OпјҢд»ҺиҖҢйӘҢиҜҒNaOHзўұжҖ§ејәдәҺNH3В·H2OпјҢ继иҖҢеҸҜд»ҘйӘҢиҜҒNaзҡ„йҮ‘еұһжҖ§ејәдәҺж°®пјҢдҪ и®ӨдёәжӯӨи®ҫи®ЎжҳҜеҗҰеҗҲзҗҶпјҹ并иҜҙжҳҺзҗҶз”ұ____гҖӮ II. еҲ©з”ЁеҰӮеӣҫиЈ…зҪ®еҸҜйӘҢиҜҒеҗҢдё»ж—Ҹе…ғзҙ йқһйҮ‘еұһжҖ§зҡ„еҸҳеҢ–规еҫӢгҖӮ  пјҲ3пјүд»ӘеҷЁBзҡ„еҗҚз§°дёә____пјҢе№ІзҮҘз®ЎDзҡ„дҪңз”Ёдёә___гҖӮ пјҲ4пјүиӢҘиҰҒиҜҒжҳҺйқһйҮ‘еұһжҖ§ClпјһIпјҢеҲҷAдёӯеҠ жө“зӣҗй…ёпјҢBдёӯеҠ KMnO4пјҲKMnO4дёҺжө“зӣҗй…ёеёёжё©дёӢеҸҚеә”з”ҹжҲҗж°Ҝж°”пјүпјҢCдёӯеҠ ж·ҖзІүзўҳеҢ–й’ҫж··еҗҲжә¶ж¶ІпјҢи§ӮеҜҹеҲ°Cдёӯжә¶ж¶І_____пјҲеЎ«зҺ°иұЎпјүпјҢеҚіеҸҜиҜҒжҳҺгҖӮд»ҺзҺҜеўғдҝқжҠӨзҡ„и§ӮзӮ№иҖғиҷ‘пјҢжӯӨиЈ…зҪ®зјәе°‘е°ҫж°”еӨ„зҗҶиЈ…зҪ®пјҢеҸҜз”Ё____жә¶ж¶Іеҗёж”¶е°ҫж°”гҖӮ пјҲ5пјүиӢҘиҰҒиҜҒжҳҺйқһйҮ‘еұһжҖ§CпјһSiпјҢеҲҷеңЁAдёӯеҠ зӣҗй…ёгҖҒBдёӯеҠ CaCO3гҖҒCдёӯеҠ Na2SiO3жә¶ж¶ІпјҢи§ӮеҜҹеҲ°Cдёӯжә¶ж¶І____пјҲеЎ«зҺ°иұЎпјүпјҢеҚіеҸҜиҜҒжҳҺгҖӮдҪҶжңүзҡ„еҗҢеӯҰи®Өдёәзӣҗй…ёе…·жңүжҢҘеҸ‘жҖ§пјҢеҸҜиҝӣе…ҘCдёӯе№Іжү°е®һйӘҢпјҢеә”еңЁдёӨиЈ…зҪ®й—ҙж·»еҠ иЈ…жңү_____жә¶ж¶Ізҡ„жҙ—气瓶йҷӨеҺ»гҖӮжӯЈдәӨзЎ«иҪ¬еҢ–дёәеҚ•ж–ңзЎ«ж—¶пјҢеҸ‘з”ҹ_____пјҲеЎ«вҖңзү©зҗҶеҸҳеҢ–вҖқжҲ–вҖңеҢ–еӯҰеҸҳеҢ–вҖқпјүгҖӮ |
|
| 24. и®Ўз®—йўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
й“Ғе’Ңй’ҙжҳҜйҮҚиҰҒзҡ„иҝҮжёЎе…ғзҙ гҖӮ (1)й’ҙдҪҚдәҺе…ғзҙ е‘ЁжңҹиЎЁдёӯ第___ж—ҸпјҢеҹәжҖҒй’ҙеҺҹеӯҗдёӯжңӘжҲҗеҜ№з”өеӯҗзҡ„дёӘж•°дёә_____гҖӮ (2)[Fe(H2NCONH2)6](NO3)3зҡ„еҗҚз§°жҳҜдёүзЎқй…ёе…ӯе°ҝзҙ еҗҲй“Ғ(в…ў)пјҢжҳҜдёҖз§ҚйҮҚиҰҒзҡ„й…ҚеҗҲзү©гҖӮиҜҘеҢ–еҗҲзү©дёӯдёӯеҝғзҰ»еӯҗFe3+зҡ„ж ёеӨ–д»·з”өеӯҗжҺ’еёғејҸдёә___пјӣе°ҝзҙ еҲҶеӯҗдёӯж°®еҺҹеӯҗзҡ„жқӮеҢ–ж–№ејҸжҳҜ___пјҢе°ҝзҙ дёӯжүҖеҗ«йқһйҮ‘еұһе…ғзҙ зҡ„з”өиҙҹжҖ§з”ұеӨ§еҲ°е°Ҹзҡ„йЎәеәҸжҳҜ___гҖӮ (3)Co(NH3)5BrSO4еҸҜеҪўжҲҗдёӨз§Қз»“жһ„зҡ„й’ҙзҡ„й…ҚеҗҲзү©пјҢе·ІзҹҘCo3+зҡ„й…ҚдҪҚж•°жҳҜ6пјҢдёәзЎ®е®ҡй’ҙзҡ„й…ҚеҗҲзү©зҡ„з»“жһ„пјҢзҺ°еҜ№дёӨз§Қй…ҚеҗҲзү©иҝӣиЎҢеҰӮдёӢе®һйӘҢпјҡ еңЁз¬¬дёҖз§Қй…ҚеҗҲзү©жә¶ж¶ІдёӯеҠ зЎқ酸银жә¶ж¶Ідә§з”ҹзҷҪиүІжІүж·ҖгҖӮ еңЁз¬¬дәҢз§Қй…ҚеҗҲзү©жә¶ж¶ІдёӯеҠ е…ҘзЎқ酸银жә¶ж¶Ідә§з”ҹж·Ўй»„иүІжІүж·ҖпјҢеҲҷ第дәҢз§Қй…ҚеҗҲзү©зҡ„й…ҚдҪ“дёә_____гҖӮ (4)зҰ»еӯҗеҢ–еҗҲзү©CaC2зҡ„дёҖз§Қжҷ¶дҪ“з»“жһ„еҰӮеӣҫ1жүҖзӨәпјҢд»Һй’ҷзҰ»еӯҗзңӢпјҢеұһдәҺ____е Ҷз§ҜпјҢе…¶й…ҚдҪҚж•°жҳҜ_____пјӣдёҖдёӘжҷ¶иғһдёӯе№іеқҮеҗ«жңүзҡ„ПҖй”®зҡ„дёӘж•°дёә_____гҖӮ 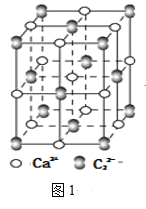 (5)科еӯҰз ”з©¶з»“жһңиЎЁжҳҺгҖӮзўізҡ„ж°§еҢ–зү©CO2иғҪеӨҹдёҺH2OеҖҹеҠ©дәҺеӨӘйҳіиғҪеҲ¶еӨҮHCOOHпјҢе…¶еҸҚеә”еҺҹзҗҶеҰӮдёӢпјҡ2CO2+2H2O=2HCOOH+O2пјҢеҲҷз”ҹжҲҗзҡ„HCOOHеҲҶеӯҗдёӯПғй”®е’ҢПҖй”®зҡ„дёӘж•°жҜ”жҳҜ____гҖӮ (6)еҘҘж°ҸдҪ“жҳҜзўіжә¶и§ЈеңЁОі-FeдёӯеҪўжҲҗзҡ„дёҖз§Қй—ҙйҡҷеӣәжә¶дҪ“пјҢж— зЈҒжҖ§пјҢе…¶жҷ¶иғһеҰӮеӣҫ2жүҖзӨәпјҢеҲҷиҜҘзү©иҙЁзҡ„еҢ–еӯҰејҸдёә______пјҢиӢҘжҷ¶дҪ“еҜҶеәҰдёәПҒg/cm3пјҢеҲҷжҷ¶иғһдёӯжңҖиҝ‘зҡ„дёӨдёӘзўіеҺҹеӯҗзҡ„и·қзҰ»дёә_____pm(йҳҝдјҸеҠ еҫ·зҪ—еёёж•°зҡ„еҖјз”ЁNAиЎЁзӨәпјҢеҶҷеҮәи®Ўз®—ејҸеҚіеҸҜ)гҖӮ 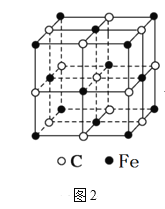 |
|
| 25. и®Ўз®—йўҳ | иҜҰз»ҶдҝЎжҒҜ |
| жҹҗе…ғзҙ еҸҠе…¶ж°”жҖҒж°ўеҢ–зү©еҢ–еӯҰејҸдёәH2RпјҢе…¶й«ҳд»·ж°§еҢ–зү©дёӯж°§зҡ„иҙЁйҮҸеҲҶж•°жҳҜ60пј…пјҢдё”иҜҘе…ғзҙ зҡ„иҙЁеӯҗж•°е’Ңдёӯеӯҗж•°зӣёзӯүпјҢеҶҷеҮәе…ғзҙ Rзҡ„зӣёеҜ№еҺҹеӯҗиҙЁйҮҸ__________е’Ңе…ғзҙ з¬ҰеҸ·___________гҖӮ | |
- 2016-2017е№ҙй«ҳдёҖдёҠеҶҢеҢ–еӯҰжңҹдёӯиҖғиҜ•иҖғиҜ•йўҳпјҲжІіеҢ—зңҒзҹіе®¶еә„дәҢдёӯпјү
- 2018еұҠй«ҳдёү12жңҲжңҲиҖғзҗҶ科综еҗҲеҢ–еӯҰиҖғеҚ·еёҰеҸӮиҖғзӯ”жЎҲе’Ңи§ЈжһҗпјҲиҙөе·һзңҒиҙөйҳіеёӮ第дёҖдёӯеӯҰпјү
- жІіеҢ—2019е№ҙй«ҳдёҖеҢ–еӯҰдёҠеҶҢжңҲиҖғжөӢйӘҢеҗҢжӯҘз»ғд№
- иҘҝи—Ҹ2019е№ҙй«ҳдёүеҢ–еӯҰдёӢеӯҰжңҹжңҲиҖғжөӢйӘҢе…Қиҙ№жЈҖжөӢиҜ•еҚ·
- 2016-2017е№ҙй«ҳдёҖдёҠеҚҠе№ҙеҢ–еӯҰжңҹдёӯиҖғиҜ•еңЁзәҝжөӢйӘҢпјҲжұҹиӢҸзңҒж·®е®үеёӮжё…жұҹдёӯеӯҰпјү
- 2016е№ҙиҮі2017е№ҙй«ҳдәҢеүҚеҚҠжңҹжңҹжң«иҖғиҜ•еҢ–еӯҰйўҳеёҰзӯ”жЎҲе’Ңи§ЈжһҗпјҲж№–еҚ—зңҒеёҲиҢғеӨ§еӯҰйҷ„еұһдёӯеӯҰпјү
- 2017-2018е№ҙй«ҳдёҖ12жңҲжңҲиҖғеҢ–еӯҰиҖғеҚ·еёҰеҸӮиҖғзӯ”жЎҲе’Ңи§ЈжһҗпјҲдёҠжө·дәӨйҖҡеӨ§еӯҰйҷ„еұһдёӯеӯҰпјү
- 2015-2016е№ҙй«ҳдёүдёӢеҶҢеҢ–еӯҰејҖеӯҰиҖғиҜ•пјҲеұұдёңзңҒеҜҝе…үзҺ°д»ЈдёӯеӯҰпјү



