桂林市高三化学月考测验(2019年上册)免费检测试卷
| 1. 选择题 | 详细信息 |
|
化学与生活、人类生产、社会可持续发展密切相关,下列有关说法正确的是( ) A. “辽宁舰”上用于舰载机降落拦阻索的是一种特种钢缆,属于新型无机非金属材料 B. 石油裂化和裂解制取乙烯、丙烯等化工原料不涉及化学变化 C. “霾尘积聚难见路人”,雾霾所形成的气溶胶没有丁达尔效应 D. 电热水器用镁棒防止金属内胆腐蚀,原理是牺牲阳极的阴极保护法 |
|
| 2. 选择题 | 详细信息 |
|
用NA表示阿伏加德罗常数的值,下列说法正确的是( ) A. 2.8g乙烯和丙烯的混合气体中共用电子对数目为0.4NA B. 1L1mol·L-1的稀硝酸中,含氧原子数为3NA C. 过氧化钠与水反应时,生成0.1 mol氧气转移的电子数为0.2NA D. 1mL 0.1mol/L FeCl3溶液滴入沸水中可生成含有1.0×10-4NA个Fe(OH)3胶粒的胶体 |
|
| 3. 选择题 | 详细信息 |
|
常温下,下列各组离子在指定溶液中能大量共存的是( ) A. 0.1 mol·L-1 FeSO4溶液:Na+、K+、Cl-、NO3- B. 滴入酚酞变红色的溶液:K+、Ca2+、HCO3-、CO32- C. 加入铁粉放出氢气的溶液:NH4+、Fe3+、ClO-、SO42- D. 水电离的c(H+)=1×10-13mol·L-1的溶液:K+、Mg2+、SO42-、F- |
|
| 4. 选择题 | 详细信息 |
|
将15.66g镁铝合金加入到800mL稀硝酸中,恰好完全反应(假设反应中还原产物只有NO),向所得溶液中加入足量的3mol·L-1NaOH溶液,测得生成沉淀的质量与原合金的质量相等,则下列有关叙述不正确的是 A. 原稀硝酸的浓度为2.6mol·L-1 B. 生成NO的体积为11.648L(标准状况) C. 反应过程中共消耗1.56molNaOH D. 合金中Al的质量分数约为58.6% |
|
| 5. 选择题 | 详细信息 | ||||||||||
已知部分弱酸的电离平衡常数如表所示
|
|||||||||||
| 6. 选择题 | 详细信息 |
钠-CO2电池的工作原理如图所示,吸收的CO2转化为Na2CO3固体和碳,沉积在多壁碳纳米管(MWCNT)电极表面,下列说法不正确的是( ) A.负极反应式为Na-e-=Na+ B.多壁碳纳米管(MWCNT)作电池的正极 C.可以用乙醇代替四甘醇二甲醚作有机溶剂 D.电池总反应式为4Na+3CO2=2Na2CO3+C |
|
| 7. 选择题 | 详细信息 |
25℃时,用0.0500 mol·L-1H2C2O4溶液滴定 25.00 mL0.l000mol·L-1NaOH溶液所得滴定曲线如图。下列说法正确的是() A.点①所示溶液中:c(H+)+c(H2C2O4)+c(HC2O4-)=c(OH-) B.点②所示溶液中:c(HC2O4-)+c(C2O42-)=c(Na+) C.点③所示溶液中:c(Na+)>c(HC2O4-)>c(H2C2O4)>c(C2O42-) D.滴定过程中可能出现:c(Na+)>c(C2O42-)=c(HC2O4-)>c(H+)>c(OH-) |
|
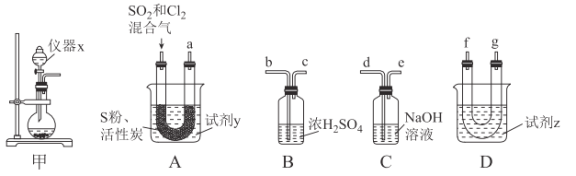
| 8. 实验题 | 详细信息 | ||||||||||
氯化亚砜(SOCl2)常用于医药、农药、染料工业,也可在有机合成工业中作氯化剂。已知:SOCl2的相关性质如下表所示:
|
|||||||||||
| 9. 综合题 | 详细信息 |
|
运用化学反应原理研究碳、氮、硫的单质及其化合物的反应对缓解环境污染、能源危机具有重要意义。 I.氨为重要的化工原料,有广泛用途。 (1)合成氨中的氢气可由下列反应制取: a. CH4(g)+H2O(g)⇌CO(g)+3H2(g) ∆H1=+216.4kJ/mol b. CO(g)+H2O(g)⇌CO2(g)+H2(g) ∆H2=-41.2kJ/mol 则反应CH4(g)+2H2O(g)⇌CO2(g)+4H2(g) ∆H=___。 (2)起始时投入氮气和氢气的物质的量分别为1mol、3mol,在不同温度和压强下合成氨。平衡时混合物中氨的体积分数与温度的关系如图。  ①恒压时,反应一定达到平衡状态的标志是___(填序号) A. N2和H2的转化率相等 B. 反应体系密度保持不变 C. ②P1___P2 (填“>”“=”或“<”,下同);反应的平衡常数:B点___D点。 ③C点H2的转化率为__; Ⅱ.用间接电化学法去除烟气中NO的原理如图所示。 (3)已知阴极室溶液呈酸性,则阴极的电极反应式为____。反应过程中通过质子膜的H+为2mol时,吸收塔中生成的气体在标准状况下的体积为____L。 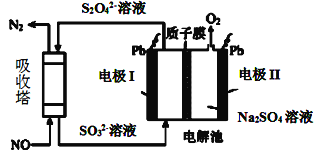 |
|
| 10. 综合题 | 详细信息 |
|
冬季我国北方大部分地区出现雾霾天气,引起雾霾的微细粒子包含(NH4)2SO4、NH4NO3、有机颗粒物、扬尘、重金属铜等。 (1)N元素原子核外电子云的形状有___种;基态铜原子的价电子排布式为___。 (2)N和O中第一电离能较小的元素是__;SO42-的空间构型___。 (3)雾霾中含有少量的水,组成水的氢元素和氧元素也能形成化合物H2O2,其中心原子的杂化轨道类型为___,H2O2难溶于CC14,其原因为___。 (4)PM2.5富含NO,NO能被FeSO4溶液吸收生成配合物[Fe(NO)(H2O)5]SO4,该配合物中心离子的配位数为___。 (5)测定大气中PM2.5浓度的方法之一是β-射线吸收法,β-射线放射源可用85Kr。已知Kr晶体的晶胞结构如图所示,设NA为阿伏加德罗常数的值,晶胞边长为540pm,则该晶体的密__g/cm3(只列式不计算,Kr摩尔质量为84g·mol-1)。  |
|
| 11. 推断题 | 详细信息 |
肉桂醛F ( 已知:两个醛分子在NaOH溶液作用下可以发生反应,生成一种羟基醛: 请回答: (1)D的名称为___。 (2)反应①~⑥中属于加成反应的是___(填序号)。 (3)写出反应③的化学方程式:____,其反应类型为____。 (4)在实验室里鉴定 A.滴加AgNO3溶液 B.加NaOH溶液 C.加热 D.用稀硝酸酸化 (5)E的同分异构体有多种,其中之一甲属于酯类。甲可由H(已知H的相对分子量为32)和芳香酸G制得,则甲的结构共有___种。 (6)根据已有知识并结合相关信息,写出以乙烯为原料制备CH3CH=CHCHO的合成路线流程图(无机试剂任选)。______。 |
|
最近更新