新疆沙雅县第二中学2018年高一化学前半期期中考试完整试卷
| 1. 选择题 | 详细信息 |
|
对危险化学品要在包装标签上印有警示性标志。氢氧化钠溶液应选用的标志是( ) A.  B. B. C. C. D. D. |
|
| 2. 选择题 | 详细信息 |
|
下列物质属于电解质的是 A.蔗糖 B.熔融NaOH C.氯水 D.铜 |
|
| 3. 选择题 | 详细信息 |
|
下列仪器不能用于加热的是 A. 量筒 B. 试管 C. 蒸发皿 D. 烧瓶 |
|
| 4. 选择题 | 详细信息 |
|
分类方法在化学学科的发展中起到了非常重要的作用,下列分类标准合理的是 A.根据酸分子中含有的氢原子个数将酸分为一元酸、二元酸等 B.根据纯净物的元素组成,将纯净物分为单质和化合物 C.根据能否与碱反应将非金属氧化物分为酸性氧化物和不成盐氧化物 D.根据其溶液是否导电,将物质分为电解质和非电解质 |
|
| 5. 选择题 | 详细信息 | ||||||||||||
下列物理量与单位对应错误的是
|
|||||||||||||
| 6. 选择题 | 详细信息 |
|
下列物质:①氯水 ②氯化氢气体 ③盐酸 ④融熔氯化钠 ⑤氯酸钾溶液 ⑥四氯化碳,其中不含氯离子的是 A.①②③ B.②④⑥ C.②⑤⑥ D.③④⑤ |
|
| 7. 选择题 | 详细信息 |
|
同温同压下,相同体积的O2和O3具有相同的 A. 密度 B. 质量 C. 分子数 D. 原子数 |
|
| 8. 选择题 | 详细信息 |
|
下列说法正确的是 A.通常状况,1 mol任何气体的体积都约是22.4 L B.H2的摩尔质量是2 g,1mol H2所占的体积是22.4 L C.在标准状况下,1 mol任何物质所占的体积都约是22.4 L D.在标准状况下,1 mol任何气体所占的体积都约是22.4 L |
|
| 9. 选择题 | 详细信息 |
|
现有三组实验:①除去混在植物油中的水 ②回收碘的CCl4溶液中的CCl4 ③用食用酒精浸泡中草药提取其中的有效成分。分离以上各混合液的正确方法依次是 A.分液、蒸馏、萃取 B.萃取、蒸馏、分液 C.分液、萃取、蒸馏 D.蒸馏、萃取、分液 |
|
| 10. 选择题 | 详细信息 |
|
利用碳酸钠晶体(Na2CO3•10H2O)来配制0.5mol•L﹣1的碳酸钠溶液950mL,假如其它操作均是准确无误的,下列情况会引起配制溶液的浓度偏高的是 A.称取碳酸钠晶体143g B.定容时俯视观察刻度线 C.移液时,对用于溶解碳酸钠晶体的烧杯没有进行冲洗 D.定容后,将容量瓶振荡均匀,静置发现液面低于刻度线,于是又加入少量水至刻度线 |
|
| 11. 选择题 | 详细信息 |
|
下列带括号的气体在反应中只作氧化剂的是 A.2F2(g)+2H2O=4HF+O2 B.SO2(g)+I2+2H2O=H2SO4+2HI C.H2S(g)+Br2=2HBr+S↓ D.3NO2(g)+H2O=2HNO3+NO |
|
| 12. 选择题 | 详细信息 |
|
下列溶液中,溶质的物质的量浓度为1mol/L的是( ) A. 含Na+为2mol的Na2SO4溶液 B. 将80g SO3溶于水并配成1L的溶液 C. 将0.5mol/L的某饱和溶液100mL,加热蒸发掉50g水后的溶液 D. 将58.5gNaCl溶于1L水所得的溶液 |
|
| 13. 选择题 | 详细信息 |
|
下列有关金属的说法正确的是 A. 纯净的生铁是黑色的,所以铁被称为黑色金属 B. 钠着火不能用泡沫灭火器扑灭 C. 铝在空气中耐腐蚀,所以铝是不活泼金属 D. 青铜、不锈钢、水银都是合金 |
|
| 14. 选择题 | 详细信息 |
|
从化合价的角度判断,下列物质中的硫元素不能表现氧化性的是 A. Na2S B. S C. SO2 D. H2SO4 |
|
| 15. 选择题 | 详细信息 |
|
下列溶液中Cl-浓度与50mL1mol/L AlCl3溶液中Cl-浓度相等的是( ) A. 150mL1mol/L的NaCl溶液 B. 75mL2mol/L的NH4Cl溶液 C. 150mL2mol/L的KCl溶液 D. 75mL1mol/L的FeCl3溶液 |
|
| 16. 选择题 | 详细信息 |
|
在强碱性溶液中能大量共存且溶液为无色透明的离子组是( ) A. Na+、K+、SO42-、MnO4- B. Na+、NH4+、NO3-、Cl- C. K+、Ba2+、HCO3-、Cl- D. K+、Na+、CO32-、NO3- |
|
| 17. 选择题 | 详细信息 |
|
要验证Mg、Fe、Cu三种金属的活动性顺序,可选用下列哪组物质进行实验 A. Cu、FeCl2溶液、MgCl2溶液 B. Fe、Cu、MgCl2溶液 C. Mg、CuO、FeSO4溶液 D. Fe、CuSO4溶液、MgCl2溶液 |
|
| 18. 选择题 | 详细信息 |
|
已知钙的活动性介于钠和钾之间(钙的密度为1.54克/厘米3),下列叙述正确的是 A.少量的钙储存在煤油 B.氧化性:K+>Ca2+>Na+ C.钙可以从K2SO4溶液中置换出钾 D.钙与水反应生成氢氧化钙和氧气 |
|
| 19. 选择题 | 详细信息 |
向盛有一定量的Ba(OH)2溶液中逐滴加入稀硫酸,直至过量,整个过程中混合溶液的导电能力(用电流强度Ⅰ表示)近似的用下图中的曲线表示是( )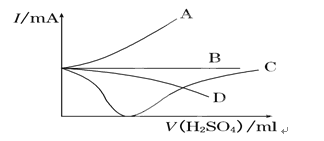 |
|
| 20. 选择题 | 详细信息 |
|
能正确表示下列反应的离子方程式的是 A. 铝与硫酸铜溶液反应:Al+Cu2+=Al3++Cu B. 碳酸钡溶于稀硝酸:CO32-+2H+=H2O+CO2↑ C. 铁与稀盐酸反应:Fe+2H+=Fe3++H2↑ D. 醋酸除水垢:2CH3COOH+CaCO3=2CH3COO-+Ca2++CO2↑+H2O |
|
| 21. 选择题 | 详细信息 |
|
设NA为阿伏加德罗常数,下列叙述正确的是 A. 标准状况下22.4L CO和CO2的混合气体中含碳原子数为NA B. 1 L 1 mol·L-1HCl溶液中含有HCl分子为NA个 C. 标准状况下,2.24 L水中约含有NA个氧原子 D. 28 g N2和CO的混合气体,所占的体积为22.4 L |
|
| 22. 选择题 | 详细信息 |
|
下列离子的检验方法正确的是 A. 加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有CO32- B. 加入氯化钡溶液有白色沉淀产生,再加稀盐酸,沉淀不消失,一定有SO42- C. 加入稀硝酸,再加入硝酸银溶液后生成白色沉淀,一定有Cl- D. 加入碳酸钠溶液产生白色沉淀,再加稀盐酸白色沉淀消失,一定有Ba2+ |
|
| 23. 选择题 | 详细信息 |
|
已知NaClO溶液与Ag反应的产物为AgCl、NaOH和O2,下列说法正确的是 A. 氧气是还原产物 B. 还原剂与氧化剂的物质的量之比为1:1 C. 反应物中有水,且反应办程式中水的化学计量数为2 D. 若生成4. 48 1(标准状况下)O2,则反应转移0.8 mol电子 |
|
| 24. 选择题 | 详细信息 |
|
甲、乙两种溶液中分别含有大量的Cu2+、K+、H+、Cl-、CO32-、OH-这6种离子中的3种(两种溶液中的离子不重复),已知甲溶液呈蓝色,则乙溶液中大量存在的离子是 A. K+、OH-、CO32- B. Cu2+、H+、Cl- C. K+、H+、Cl- D. CO32-、OH-、Cl- |
|
| 25. 选择题 | 详细信息 |
|
V L Fe2(SO4)3溶液中含有ag SO42-,取此溶液0.5V L,用水稀释至2V L,则稀释后溶液中Fe3+的物质的量浓度为( ) A. |
|
| 26. 填空题 | 详细信息 |
|
(1)1molO3的质量为________,O2的摩尔质量为________,2molO3和3molO2的质量之比为_____,分子数之比为_____,同温同压下的密度之比为_____.含氧原子数之比为_____. (2)10.6gNa2CO3溶于水配成500mL 溶液,物质的量浓度为_________,其中Na+的物质的量浓度为________。 (3)标准状况下11.2LHCl气体的物质的量为________,所含氢原子与________g CH4中的氢原子数相同 |
|
| 27. 填空题 | 详细信息 |
|
(1)在K2Cr2O7+14HCl═2KCl+2CrCl3+3Cl2↑+7H2O反应中,_____是氧化剂,_____元素被氧化,还原产物是_____,HCl表现的性质是_____,电子转移的数目是_____. (2)有下列物质:铁、稀盐酸、胆矾、二氧化碳、氢氧化铁胶体、四氯化碳。用化学用语填空。属于有机化合物的是__________,属于酸性氧化物的是_________,能够产生丁达尔现象的是__________,属于电解质的是__________,其中两种物质之间反应能产生气体的离子方程式是__________。 |
|
| 28. 填空题 | 详细信息 |
|
已知:Fe+2FeCl3=3FeCl2,Cu+2FeCl3=CuCl2+2FeCl2.将Fe、Cu粉与FeCl3溶液混合放在某一容器里,根据下述情况判断哪些阳离子或金属单质存在,哪些不能存在. (1)反应后铁有剩余,则容器里可能有_____. (2)反应后有Cu2+和Cu,则容器里不可能有_____. (3)反应后有Cu2+,Fe3+,则容器里不可能有_____. |
|
| 29. 实验题 | 详细信息 |
|
实验室配制100mL 0.5mol/L的Na2CO3溶液,有如下操作步骤:①将称量好的Na2CO3固体放入烧杯中,加入适量的蒸馏水溶解;②把①所得溶液小心转入100mL容量瓶中;③继续向容量瓶中加蒸馏水至液面距刻度线1~2cm处,小心滴加蒸馏水至溶液凹液面与刻度线相切;④用少量蒸馏水洗涤烧杯2~3次,每次洗涤的液体都小心转入容量瓶中并轻轻摇匀;⑤计算所需Na2CO3固体的质量并用托盘天平称取;⑥塞紧容量瓶的塞子,充分摇匀.回答下列问题: (1)本实验操作步骤的正确顺序是(填序号)_________. (2)本实验中除用到玻璃棒和烧杯外,还需要用到的玻璃仪器有_______、_________。 (3)实验中用托盘天平实际称取Na2CO3固体的质量是 _______. (4)在实验中,若出现如下情况,对所配溶液的浓度有何影响?未进行操作④,所配溶液的浓度会______(填“偏高”、“偏低”或“无影响”,下同);定容时俯视液面,所配溶液的浓度会______. (5)若实验过程中出现如下情况应如何处理?加蒸馏水时不慎超过了刻度线______,向容量瓶中转移溶液时,不慎有少量溶液洒在容量瓶外面______. |
|
| 30. 填空题 | 详细信息 |
|
金属及其化合物在人类生活、生产中发挥着重要的作用. (1)铁是人类应用最广的金属,工业上用铁矿石(主要成分为Fe2O3 )、焦炭、石灰石在高炉中冶炼得到,高炉炼铁的主要化学反应方程式为__________________ ,其中石灰石的作用是____________________ 。 (2)铝是常见的金属,铝制容器既不能存放酸性物质,也不能存放碱性物质,其原因分别用离子方程式表示:_____________、 _____________ 。 |
|
| 31. 实验题 | 详细信息 | |||||||
某化学兴趣小组的同学学习了同周期元素性质递变规律后,设计了一套实验方案进行实验探究,并记录了有关实验现象如下表.
|
||||||||
最近更新



