海安高级中学试卷带解析及答案
| 1. 选择题 | 详细信息 |
|
下列化学用语正确的是 A.纯碱溶液除去油污:CO B.H2S的水溶液呈酸性:H2S⇌2H++S2- C.饱和Na2CO3溶液与CaSO4固体反应:CO D.钢铁发生原电池反应的负极反应式:Fe−3eˉ=Fe3+ |
|
| 2. 选择题 | 详细信息 |
|
下列事实不能用勒夏特列原理解释的是 A. 加入二氧化锰可使单位时间内过氧化氢分解产生氧气的量增多 B. 工业生产硫酸,通入过量的空气,提高二氧化硫的转化率 C. 久置氯水pH变小 D. 温度升高,Kw增大 |
|
| 3. 选择题 | 详细信息 |
|
一定条件下,将NH3与O2以体积比1∶2置于体积不变的密闭容器中,发生反应4NH3(g)+5O2(g)⇌4NO(g)+6H2O(g),下列能说明反应达到平衡状态的是 A.达到化学平衡时,5v正(O2)=4v逆(NO) B.NO和H2O的物质的量浓度比保持不变 C.混合气体的平均相对分子质量保持不变 D.混合气体的密度不再改变 |
|
| 4. 选择题 | 详细信息 |
|
下列实验原理或操作正确,能达到实验目的的是 A.  测pH B. 测pH B. 蒸发制无水MgCl2 C. 蒸发制无水MgCl2 C. 滴定 D. 滴定 D. 制备少量Fe(OH)2 制备少量Fe(OH)2 |
|
| 5. 选择题 | 详细信息 |
|
在下列给定条件的溶液中,一定能大量共存的离子组是 A.能使甲基橙显红色的溶液:K+、Fe2+、NO B.含有大量Al3+的溶液中:Na+、Mg2+、HCO C.常温下,水电离产生c(H+)=1×10-14的溶液中:K+、Na+、Cl-、SO D. |
|
| 6. 选择题 | 详细信息 |
利用如图所示装置,当X、Y选用不同材料时,可将电解原理广泛应用于工业生产,下列说法中正确的是 A.Z是AgNO3溶液,X、Y均为Pt,Y电极上有O2产生 B.氯碱工业中,X、Y均为石墨,Y附近能得到氢氧化钠 C.铜的精炼中,X是纯铜,Y是粗铜,Z是CuSO4溶液 D.电镀工业中,X是待镀金属,Y是镀层金属 |
|
| 7. 选择题 | 详细信息 |
工业上可通过甲醇羰基化法制取甲酸甲酯(HCOOCH3):CH3OH(g)+ CO(g)=HCOOCH3(g),在容积固定的密闭容器中,投入等物质的量CH3OH和CO,测得相同时间内CO的转化率随温度变化如右图所示。下列说法不正确的是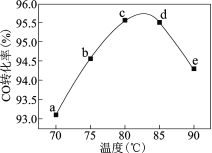 A.增大压强甲醇转化率增大 B.b点反应速率υ正 = υ逆 C.平衡常数K(75℃)>K(85℃),反应速率υb<υd D.生产时反应温度控制在80~85℃为宜 |
|
| 8. 选择题 | 详细信息 |
|
下列说法正确的是 A.pH=1的醋酸加水稀释到原体积的100倍,稀释后pH=3 B.某温度下,水的离子积常数为1×10-12,该温度下pH=7的溶液呈中性 C.室温下pH相同的NH4Cl溶液和CH3COOH溶液,由水电离产生的c(H+)相同 D.室温下pH=1的CH3COOH溶液和pH=13的NaOH溶液中,c(CH3COO‾)=c(Na+) |
|
| 9. 选择题 | 详细信息 |
|
下列图示与对应的叙述相符的是 A.  图表示温度T1>T2,SO2与O2反应过程中的能量变化 图表示温度T1>T2,SO2与O2反应过程中的能量变化B.  图表示反应N2(g)+3H2(g)⇌2NH3(g)在t1时刻扩大容器体积时,v逆随时间的变化曲线 图表示反应N2(g)+3H2(g)⇌2NH3(g)在t1时刻扩大容器体积时,v逆随时间的变化曲线C.  图表示电解200 mL 0.1 mol·L-1 NaCl溶液过程中,产生氢气体积(标准状况)与转移电子物质的量的关系曲线 图表示电解200 mL 0.1 mol·L-1 NaCl溶液过程中,产生氢气体积(标准状况)与转移电子物质的量的关系曲线D.  图表示在饱和Na2CO3溶液中逐步加BaSO4固体后,溶液中c(CO 图表示在饱和Na2CO3溶液中逐步加BaSO4固体后,溶液中c(CO |
|
| 10. 选择题 | 详细信息 |
以TiO2为催化剂的光热化学循环分解CO2反应为温室气体减排提供了一个新途径,该反应的机理及各分子化学键完全断裂时的能量变化如下图所示。  下列说法正确的是 A.过程①中钛氧键断裂会释放能量 B.该反应中,光能和热能转化为化学能 C.使用TiO2作催化剂可以降低反应的焓变,从而提高化学反应速率 D.CO2分解反应的热化学方程式为2CO2(g) =2CO(g) + O2(g) ΔH= + 30 kJ/mol |
|
| 11. 选择题 | 详细信息 |
|
下列说法正确的是 A.常温下,向稀醋酸溶液中缓慢通入少量NH3,溶液中  值增大 值增大B.反应2NO(g)+2CO(g)=N2(g)+2CO2(g)在常温下可自发进行,则该反应的△H>0 C.铅蓄电池充电时,阳极区溶液的pH和阳极质量均减小 D.加入硫酸铜可使锌与稀硫酸的反应速率加快,说明Cu2+具有催化作用 |
|
| 12. 选择题 | 详细信息 |
我国科学家研制了一种新型的高比能量锌碘溴液流电池,其工作原理示意图如图。图中贮液器可储存电解质溶液,提高电池的容量。下列叙述不正确的是 A.放电时,a电极反应为I2Br-+2e-=2I-+Br- B.放电时,电子从电极b流出,经电解质溶液流向电极a C.充电时,b电极每增重0.65 g,溶液中有0.02 mol I-被氧化 D.充电时,a电极接外电源负极 |
|
| 13. 选择题 | 详细信息 | ||||||||||||||||||||
下列实验操作、现象及根据现象得出的结论,都正确的是
|
|||||||||||||||||||||
| 14. 选择题 | 详细信息 |
|
常温下,下列溶液中微粒的物质的量浓度关系正确的是 A.向0.10 mol·L-1 CH3COONa溶液滴加0.10 mol·L-1HCl溶液恰好使至溶液呈中性: c(Na+)>c(CH3COO-)>c(CH3COOH)>c(Cl-) B.将Na2CO3和NaHCO3的稀溶液混合恰好至溶液中c(CO C.向0.10 mol·L-1NH4HSO4溶液中滴加NaOH溶液恰好呈中性:c(Na+) = c(SO D.将等体积等物质的量浓度CH3COONa和NaF溶液混合:c(CH3COOH)+c(HF)=c(OH-)-c(H+) |
|
| 15. 选择题 | 详细信息 |
在三个容积相同的恒容密闭容器中,起始时按表中相应的量加入物质,在相同温度下发生反应CH4(g)+H2O(g)⇌CO(g)+3H2(g)(不发生其他反应),CH4的平衡转化率与温度、压强的关系如右下图所示。  下列说法错误的是 A. 该反应的ΔH>0,图中压强P1>P2 B. 起始时,容器Ⅱ中v(CH4)正<v(CH4)逆 C. 达到平衡时,容器Ⅰ、Ⅱ中CO的物质的量满足:n(CO)Ⅱ<2n(CO)Ⅰ D. 达到平衡时,容器Ⅱ、Ⅲ中气体的总压强之比:pⅡ∶pⅢ=4∶5 |
|
| 16. | 详细信息 |
|
硫酸镍溶于氨水形成[Ni(NH3)6]SO4蓝色溶液,回答下列问题: (1)基态Ni2+的电子排布式为_______。 (2)①在1mol[Ni(NH3)6]2+中含有σ键的数目为_______。 ②Ni、N、O三种元素的第一电离能由小到大的顺序是为_____。 ③液氨中存在电离平衡2NH3⇌NH (3)氧化镍晶胞如图所示,镍离子的配位数为_______。  已知晶胞参数为a cm,NA为阿伏加德罗常数的值,则氧化镍晶体密度为______g/cm3。 |
|
| 17. | 详细信息 |
|
随着化石能源的减少,新能源的开发利用日益迫切。对化石能源燃烧产生的CO、CO2的研究和深度的应用对构建生态文明社会也具有重要的意义。 (1)Bunsen热化学循环制氢工艺由下列三个反应组成: SO2(g)+I2(g)+2H2O(g)=2HI(g)+H2SO4(l) ΔH1=a kJ·mol-1 2H2SO4(l)=2H2O(g)+2SO2(g)+O2(g) ΔH2=b kJ·mol-1 2HI(g)=H2(g)+I2(g) ΔH3=c kJ·mol-1 则:2H2O(g)=2H2(g)+O2(g) ΔH=____ kJ·mol-1。 (2)硅光电池作为电源已广泛应用于人造卫星、灯塔和无人气象站等,工业制备纯硅的反应为2H2(g)+SiCl4(g)=Si(s)+4HCl(g) ΔH=+240.4 kJ·mol-1。若将生成的HCl通入100 mL1 mol·L-1的NaOH溶液中恰好完全反应,则在此制备纯硅反应过程中的热效应是____kJ。 (3)使用电化学一氧化碳气体传感器定量检测空气中CO含量,其模型如下左图所示。这种传感器利用了原电池原理,则该电池的负极反应式为______。  (4)将燃煤产生的二氧化碳回收利用,可达到低碳排放的目的。右图是通过光电转化原理以廉价原料制备新产品的示意图。催化剂a、b之间连接导线上电子流动方向是_______(填“a→b”或“b→a”)。 (5)人体血液里主要通过碳酸氢盐缓冲体系(  ,1g2=0.3。由题给数据可算得正常人体血液的pH约为______,当过量的酸进入血液中时,血液缓冲体系中 ,1g2=0.3。由题给数据可算得正常人体血液的pH约为______,当过量的酸进入血液中时,血液缓冲体系中 的值将____(填“变大、变小、不变”)。 的值将____(填“变大、变小、不变”)。 |
|
| 18. | 详细信息 | |||||||||||||||
常温下,用含钴废料(主要成分为CoCO3,还含有少量NiCO3与铁屑)制备CoCl2•6H2O的工艺流程如图。 ①已知除镍过程中溶液pH对钴的回收率及Ni2+含量的影响如图所示。  ②部分金属阳离子在实验条件下开始沉淀和完全沉淀的pH如表所示:
|
||||||||||||||||
| 19. | 详细信息 |
|
氮的氧化物是造成大气污染的主要物质。研究氮氧化物的反应机理对于消除环境污染有重要意义。 (1)催化氧化法去除NO是在一定条件下,用NH3消除NO污染,其反应原理为4NH3+6NO ①n(NH3):n(NO)的物质的量之比为1:3时,对应的是曲线_________(填“a”“b”或“c”)。 ②由图1可知,无论以何种比例反应,在温度超过900 ℃时NO脱除率都会骤然下降的原因可能是_________。  (2)NO氧化反应:2NO(g)+O2(g)⇌2NO2(g)分两步进行,其反应过程能量变化示意图如图2。 Ⅰ.2NO(g) →N2O2(g);ΔH1 Ⅱ.N2O2(g)+O2(g) →2NO2(g);ΔH2 ①化学反应速率有速率较慢的反应步骤决定。以上反应决定NO氧化反应速率的步骤是 ___(填“Ⅰ”或“Ⅱ”)。 ②在恒容的密闭容器中充入一定量的NO和O2气体,保持其他条件不变,控制反应温度分别为T3和T4(T4>T3),测得c(NO)随t(时间)的变化曲线如图3。转化相同量的NO,在温度_____(填“T3”或“T4”)下消耗的时间较长,试结合反应过程能量图(图2)分析其原因:______。  (3)新型绿色硝化剂N2O5可以通过N2O4为原料用电解法制备,实验装置如图4所示。则电极B接直流电源的_________极,电解池中生成N2O5的电极反应式为_________。 |
|
| 20. | 详细信息 |
|
化石燃料燃烧时会产生SO2进入大气形成酸雨,有多种方法可用于SO2的脱除。 (1)NaClO碱性溶液吸收法。工业上常用碱性NaClO废液吸收SO2,反应原理为:ClO− + SO2 + 2OH− = Cl− + SO  a.过程1的离子方程式是Ni2O3 + ClO-=2NiO2 + Cl-,过程2的离子方程式为__________。 b.Ca(ClO)2也可用于脱硫,且脱硫效果比NaClO 更好,原因是_________。 (2)Na2CO3溶液、氨水等碱性溶液吸收法。已知25℃时,含硫物种(即水溶液中H2SO3、HSO  ①当用Na2CO3溶液吸收SO2至溶液的pH为4时,发生反应的离子方程式是________。 ②当用氨水吸收SO2至溶液的pH=7时,NH ③由实验测得氨水脱除SO2时,脱硫效率随pH的变化如图-2所示。在pH<5.5,pH较小时脱硫效率低的可能原因是___________;实际工艺中,吸收液的pH应控制在一定范围内,pH不宜过大的原因是_____________。 |
|



