海安高级中学高二化学2018年上册月考测验带答案与解析
| 1. 选择题 | 详细信息 |
|
下列说法不正确的是 A. 由1 mol H2形成2 mol H要吸收热量 B. 化学反应是放热还是吸热与反应的条件无关 C. 氢能、核能、化石燃料均是无污染的高效能源 D. “冰,水为之,而寒于水”,说明相同质量的水和冰,水的能量髙 |
|
| 2. 选择题 | 详细信息 |
|
已知:A2(g)+B2(g)=2AB(g) △H=-270kJ/mol,下列说法正确的是 A. 2LAB气体分解成1L的A2(g)和1L的B2(g)吸收270kJ热量 B. 在相同条件下,1molA2(g)与1mol B2(g)的能量总和大于2molAB(g)气体的能量 C. 1个A2(g)分子与1个B2(g)分子反应生成2个AB(g)分子放出270kJ D. 1mo1A2(g)与1mol B2(g)反应生成2mol液态AB放出的热量小于270kJ |
|
| 3. 选择题 | 详细信息 |
在一体积不变的密闭容器中发生化学反应:2A(g)  则下列有关说法中正确的是 A. 条件I、条件II时的反应温度不同,压强相同 B. 条件I时可能未使用催化剂,条件II时可能使用了催化剂 C. 条件III时的平衡混合物中,物质C的浓度等于0.6 mol·L-1 D. 条件IV和条件II相比较,条件IV时可能缩小了容器体积 |
|
| 4. 选择题 | 详细信息 |
|
下列有关化学反应速率和限度的说法中,不正确的是 A. 实验室用H2O2分解制O2,加入MnO2后,反应速率明显加快 B. 在金属钠与足量水反应中,增加水的量能加快反应速率 C. 2SO2+O2 D. 实验室用碳酸钙和盐酸反应制取CO2,若将块状碳酸钙粉碎,会加快反应 |
|
| 5. 选择题 | 详细信息 |
|
制取甲烷的反应为C(s)+2H2(g) A. 降温 B. 恒温恒压时加入一定量H2 C. 增大C(s)的量 D. 压缩容器体积 |
|
| 6. 选择题 | 详细信息 | ||||||||||||||||||||||||||||||||||||||||
在10 L恒容密闭容器中充入X(g)和Y(g),发生反应X(g)+Y(g)
|
|||||||||||||||||||||||||||||||||||||||||
| 7. 选择题 | 详细信息 |
下列关于反应过程中能量变化的说法正确的是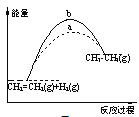 A. 图中a、b曲线可分别表示反应CH2=CH2(g)+H2(g)→CH3CH3(g) ΔH<0使用和未使用催化剂时,反应过程中的能量变化 B. 己知2C(s)+2O2(g)=2CO2(g) ΔH1;2C(s)+O2(g)=2CO(g) ΔH2。则ΔH1>ΔH2 C. 同温同压下,反应H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的ΔH不同 D. 在一定条件下,某可逆反应的ΔH=+100kJ·mol-1,则该反应正反应活化能比逆反应活化能大100kJ·mol-1 |
|
| 8. 选择题 | 详细信息 |
|
钛被称为“第三金属”,其制取原料为金红石(TiO2),制取步骤为: TiO2 → TiCl4 已知:①C(s)+O2(g)===CO2(g) ΔH1 ②2CO(g)+O2(g)===2CO2(g) ΔH2 ③TiO2(s)+2Cl2(g)===TiCl4(s)+O2(g) ΔH3 则反应TiO2(s)+2Cl2(g)+2C(s)===TiCl4(s)+2CO(g)的ΔH为 A. ΔH3+2ΔH1+2ΔH2 B. ΔH3+2ΔH1+ΔH2 C. ΔH3+2ΔH1-ΔH2 D. ΔH3+2ΔH1-2ΔH2 |
|
| 9. 选择题 | 详细信息 |
|
在恒温恒压的密闭容器内发生如下反应:2NO(g) A. 不变 B. 增大 C. 减小 D. 无法判断 |
|
| 10. 选择题 | 详细信息 |
对于可逆反应:2A(g)+B(g) A. A B. B C. C D. D |
|
| 11. 选择题 | 详细信息 |
|
下列说法正确的是 A. 增大压强或升高温度,一定能使化学反应速率加快 B. 已知Ni(CO)4(g)=Ni(s)+4CO(g) ΔH=Q kJ/mol,则Ni(s)+4CO(g)=Ni(CO)4(g) ΔH=-Q kJ/mol C. 500℃、30 MPa下,0.5 mol N2(g)和1.5 mol H2(g)反应生成NH3(g)放热Q kJ,其热化学方程式为N2(g)+3H2(g) D. 已知两个平衡体系:2NiO(s) |
|
| 12. 选择题 | 详细信息 |
|
在密闭容器中发生反应:xA(g)+yB(s) A. x<z B. 平衡向正反应方向移动 C. A的转化率降低 D. C的体积分数增大 |
|
| 13. 选择题 | 详细信息 |
|
一定条件下,将3molA和1molB两种气体混合于固定容积为2L的密闭容器中,发生如下反应:3A(g)+B(g) A. 从开始到平衡A的平均反应速率为0.3mol/(L B. 从开始到平衡B的转化率为60% C. 此反应的化学平衡常数表达式: D. 若混合气体的密度或压强不再改变时,该反应一定达到平衡状态 |
|
| 14. 选择题 | 详细信息 |
在容积不变的密闭容器中存在如下反应:2SO2(g)+O2(g) A. 图Ⅰ表示的是t1时刻增大O2的浓度对反应速率的影响 B. 图Ⅱ表示的是t1时刻通入氦气增大体系压强对反应速率的影响 C. 图Ⅱ表示的t1时刻加入催化剂后对反应速率的影响 D. 图Ⅲ表示的是温度对化学平衡的影响,且乙的温度较高 |
|
| 15. 选择题 | 详细信息 | ||||||||||||||||
|
恒温恒容下,向2L密闭容器中加入MgSO4和CO(g),发生反应: MgSO4(s)+CO(g)
|
|||||||||||||||||
| 16. 实验题 | 详细信息 |
某研究小组将V1mL0.50mol/LH2SO4溶液和V2mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验装置和实验结果如下图所示(实验中始终保持V1 +V2=50mL)。回答下列问题: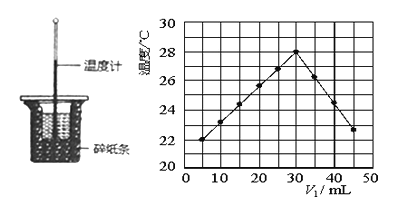 (1)上图所示实验装置中有一个明显的错误________________。 (2)为了减少实验误差,实验过程中将NaOH溶液________________ (选填“一次”或“分多次”)倒入盛有稀硫酸的小烧杯中。溶液混合后,准确读取混合溶液的____________,记为终止温度。 (3)研究小组做该实验时环境温度________ 22°C(填“高于”、“ 低于”或“等于”),判断的依据是___________________。 (4)由题干及图形可知,V1:V2=_________时,酸碱恰好完全中和,此反应所用NaOH溶液的浓度应为_________ mol/L。 (5)若通过实验测定及有关计算知此反应共放出a kJ的热量.请写出此反应的热化学方程式:_____。 |
|
| 17. 综合题 | 详细信息 |
|
碳是形成化合物种类最多的元素,其单质及化合物是人类生产生活的主要能源物质。请回答下列问题: (1)有机物M经过太阳光光照可转化成N,转化过程如下:  则M、N相比,较稳定的是____________。 (2)已知CH3OH(l)的燃烧热为726.5kJ·mol-1,CH3OH(l) + 1/2O2(g) ═ CO2(g) + 2H2O(g) △H=-akJ·mol-1,则a_____726.5(填“>”、“<”或“=”)。 (3)使Cl2和H2O(g)通过灼热的炭层,生成HCl和CO2,当有1molCl2参与反应时释放出145kJ热量,写出该反应的热化学方程式_______________________。 (4)火箭和导弹表面的薄层是耐高温物质。将石墨、铝粉和二氧化钛按一定比例混合在高温下煅烧,所得物质可作耐高温材料,4Al(s)+3TiO2(s)+3C(s)═2Al2O3(s)+3TiC(s) △H=-1176kJ·mol-1,则反应过程中,每转移1mol电子放出的热量为_________________。 (5)已知:Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g) △H=+489.0kJ·mol-1 CO(g)+1/2O2(g)=CO2(g) △H=-283.0kJ·mol-1 C(石墨)+O2(g) =CO2(g) △H=-393.5kJ·mol-1 则4Fe(s)+3O2(g)=2Fe2O3(s) △H=______________。 |
|
| 18. 填空题 | 详细信息 |
|
无色气体N2O4是一种强氧化剂,为重要的火箭推进剂之一。N2O4与NO2转换的热化学方程式为N2O4(g) (1)将一定量N2O4投入固定容积的真空容器中,下述现象能说明反应达到平衡的是 _________。 a.v正(N2O4)=2v逆(NO2) b.体系颜色不变 c.气体平均相对分子质量不变 d.气体密度不变 达到平衡后,保持体积不变升高温度,再次到达平衡时,混合气体颜色____(填 “变深”“变浅”或“不变”),判断理由_______。 (2)平衡常数K可用反应体系中气体物质分压表示,即K表达式中用平衡分压代替平衡浓度,分压=总压×物质的量分数[例如:p(NO2)=p总×x(NO2)]。写出上述反应平衡常数Kp表达式 _______________________(用p总、各气体物质的量分数x表示);影响Kp的因素_________________。 (3)上述反应中,正反应速率v正=k正·p(N2O4),逆反应速率v逆=k逆·p2(NO2),其中k正、k逆为速率常数,则Kp为____(以k正、k逆表示)。若将一定量N2O4投入真空容器中恒温恒压分解(温度298 K、压强100 kPa),已知该条件下k正=4.8×104 s-1,当N2O4分解10%时,v正=______________kPa·s-1。 (4)真空密闭容器中放入一定量N2O4,维持总压强p0恒定,在温度为T时,平衡时N2O4分解百分率为α。保持温度不变,向密闭容器中充入等量N2O4,维持总压强在2p0条件下分解,则N2O4的平衡分解率的表达式为__________________________。 |
|
| 19. 填空题 | 详细信息 | ||||||||||||||||||||||||||||||||||
|
甲烷是一种理想的洁净燃料,利用甲烷与水反应制备氢气,因原料廉价,具有推广价值。该反应为CH4(g)+H2O(g) (1)800℃时,反应的化学平衡常数K=l.0,某时刻测得该温度下密闭容器中各物质的物质的量浓度如表。则此时正、逆反应速率的关系是____。
|
|||||||||||||||||||||||||||||||||||
| 20. 填空题 | 详细信息 |
将1molI2(g)和2molH2(g)置于某2L密闭容器中,在一定温度下发生反应:I2(g)+H2(g)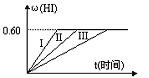 (1)达平衡时,I2(g)的物质的量浓度为____________,H2(g)的平衡转化率为___________,在此温度下,该反应的平衡常数K=____________(保留一位小数)。 (2)若改变反应条件下,在甲条件下ω(HI)的变化如图曲线(I)所示,在乙条件下ω(HI)的变化如图曲线(III)所示。则甲条件可能是_________(填入下列条件的序号,下同),乙条件可能是__________。 ① 恒容条件下,升高温度 ② 恒容条件下,降低温度 ③ 恒温条件下,缩小反应容器体积 ④ 恒温条件下,扩大反应容器体积 ⑤ 恒温恒容条件下,加入适当催化剂 (3)若保持温度不变,在另一相同的2L密闭容器中加入a mol I2(g)、b mol H2和c mol HI(a、b、c均大于0),发生反应达平衡时,HI的体积分数仍为0.60,则a、b、c的应满足的关系是___________(用含一个a、b、c的代数式表示) |
|
| 21. 综合题 | 详细信息 | |||||||||||||||||||||||||||
|
研究NO2、SO2、CO等大气污染气体的测量及处理具有重要意义。 (1)降低汽车尾气的方法之一是在排气管上安装催化转化器,发生如下反应:2NO(g)+2CO(g) ①一定条件下,将体积比为1∶2的NO、CO气体置于恒容密闭容器中发生上述反应,下列能说明反应达到平衡状态的是___(填字母)。 A.体系压强保持不变 B.混合气体颜色保持不变 C.N2和CO2的体积比保持不变 D.v正(CO)=2v逆(N2) ②20min时,若改变反应条件,导致N2浓度发生如下图所示的变化,则改变的条件可能是______(填字母)。 A.加入催化剂 B.降低温度 C.增加CO2的量 D.缩小容器体积 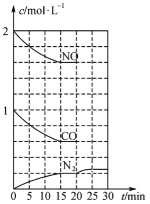 (2)在一定条件下,将SO2和NO2通入绝热恒容密闭容器中,发生反应:SO2(g)+NO2(g)  A.反应在c点达到平衡状态 B.反应物浓度:b点小于c点 C.反应物的总能量低于生成物的总能量 D.△t1=△t2时,SO2的转化率:a~b段小于b~c段 (3)采用一种新型的催化剂(主要成分是Cu-Mn的合金),利用CO和H2可制备二甲醚(DME)。观察图回答问题。 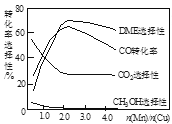 催化剂中n(Mn)/n(Cu)约为__________时最有利于二甲醚的合成。 (4)工业上可以用CO和H2生产燃料甲醇:CO(g)+2H2(g)
|
||||||||||||||||||||||||||||
- 高中化学人教版 必修1 第三章 金属及其化合物 2.几种重要的金属化合物 铁的重要化合物
- 黄金30题系列 高二化学 小题好拿分
- 2016-2017年高一下半期理综化学开学考试(安徽师大附中)
- 高中化学人教版 必修2 第四章 化学与自然资源的开发利用 第一节 开发利用金属矿物和海水资源 海水资源的开发利用
- 2017-2018年高二12月联考化学考试题(河南省豫北重点中学)
- 2016-2017年高一下半年化学开学考试专题训练(广西省桂林市第十八中学)
- 高中化学人教版 选修四 第三章 水溶液中的离子反应 第二节 水的电离和溶液的酸碱性 水的电离和溶液的酸碱性第二课时
- 2016-2017年高一上册化学期中考试考卷带参考答案和解析(山东省淄博市淄川一中)



