江西省赣州市寻乌中学2020届高三上半年第一阶段考试化学考题
| 1. 选择题 | 详细信息 |
|
生活中处处存在化学,下列说法不正确的是( ) A.《本草纲目》中“冬月灶中所烧薪柴之灰,令人以灰淋汁,取碱浣衣”中的碱是K2CO3 B.福尔马林用于标本的制作是利用了使蛋白质变性的性质 C.含钙、钡、铂等金属元素的物质有绚丽的颜色,可用于制造焰火 D.在清理厕所时洁厕灵和84消毒液不能混用,否则可能发生中毒现象 |
|
| 2. 选择题 | 详细信息 |
|
中国科学技术名词审定委员会已确定第116号元素Lv的名称为鉝。关于 A. 原子序数116 B. 中子数177 C. 核外电子数116 D. 相对原子质量293 |
|
| 3. 选择题 | 详细信息 |
|
下列有关化学用语使用正确的是( ) A.CO2的电子式: C.乙烯的比例模型:  D.铝离子结构示意图: D.铝离子结构示意图: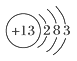 |
|
| 4. 选择题 | 详细信息 |
|
下列试剂的保存方法正确的是( ) A.少量金属钠保存在水中 B.新制氯水存放在带玻璃塞的无色细口瓶中 C.碳酸钠固体保存在带橡胶塞的广口瓶中 D.浓硝酸保存在带橡胶塞的无色玻璃瓶中 |
|
| 5. 选择题 | 详细信息 |
|
NA表示阿伏加德罗常数的值,下列有关说法正确的是( ) A.常温常压下,16g14CH4所含中子数目为8NA B.标准状况下,2.24LCHCl3中含有共价键数目为0.4NA C.含0.2NA个阴离子的Na2O2和水完全反应转移0.2mol电子 D.0.1L3mol·L-1的NH4NO3溶液中含有的NH4+数目为0.3NA |
|
| 6. 选择题 | 详细信息 | ||||||||||||||||||||
下列实验操作、实验现象与结论的对应关系正确的是( )
|
|||||||||||||||||||||
| 7. 选择题 | 详细信息 |
|
下列说法不正确的是 A.热的纯碱液去油污效果好,因为加热可使CO32-的水解程度增大,溶液碱性增强,去污力增强 B.铁在潮湿的环境下生锈以及Mg与NH4Cl溶液反应生成H2都与盐类水解有关 C.将Al2(SO4)3溶液加热、蒸干、灼烧,可得到固体Al2(SO4)3 D.将饱和FeCl3溶液滴入沸水中制胶体,离子方程式:Fe3++3H2O |
|
| 8. 选择题 | 详细信息 |
|
NaNO2一种食品添加剂,它致癌。酸性KMnO4溶液与NaNO2的反应方程式是MnO4-+NO2-+ A.该反应中NO2-被还原 B.反应过程中溶液的pH减小 C.生成1molNaNO3需消耗0.4 mol KMnO4 D. |
|
| 9. 选择题 | 详细信息 |
|
短周期主族元素W、X、Y、Z的原子序数依次增大,W、Y同主族,二者形成的一种化合物具有金刚石的结构。X的最外层电子数等于最内层电子数,Z元素是最重要的“成盐元素”。下列说法正确的是( ) A.原子半径:Z>Y>X B.氢化物沸点:Z>Y>W C.元素X的单质能与W的氧化物发生置换反应 D.Z与W、X、Y形成的化合物中化学键类型均相同 |
|
| 10. 选择题 | 详细信息 |
某有机物的结构简式如图所示,有关该有机物的叙述正确的是 A.分子中含有3 种官能团 B.在一定条件下,能发生取代、氧化、酯化和加聚反应 C.该物质分子中最多可以有10 个碳原子在同一平面上 D.1 mol 该物质最多可与5 mol H2 发生加成反应 |
|
| 11. 选择题 | 详细信息 |
|
下列体系中,离子能大量共存的是( ) A.无色透明的酸性溶液:MnO4-、K+、C1-、SO42- B.使酚酞变红的溶液:K+、Na+、NO3-、Cl- C.滴加KSCN显红色的溶液:NH4+、K+、Cl-、S2- D.0.1 mol·L-1 NaHCO3溶液: Na+、Ba2+、NO3-、OH- |
|
| 12. 选择题 | 详细信息 |
|
在复杂的体系中,确认化学反应先后顺序有利于解决问题,下列化学反应先后顺序判断不正确的是 A.在含Ba(OH)2、KOH的混合溶液中缓慢通入CO2: Ba(OH)2、KOH、K2CO3、BaCO3 B.在含NH4+、Al3+、H+的溶液中逐滴加入KOH溶液:H+、Al3+、NH4+、Al(OH)3 C.在含AlO2-、OH-、CO32-的溶液中逐滴加入盐酸:AlO2-、Al(OH)3、OH-、CO32- D.在含等物质的量的Fe2+、Ag+、Cu2+、H+的溶液中加入锌粉:Ag+、Cu2+、H+、Fe2+ |
|
| 13. 选择题 | 详细信息 |
|
下列反应的离子方程式书写正确的是 A.过量HI溶液加入到Fe(NO3)3溶液中:2Fe3++2I-=2Fe2++I2 B.含等物质的量的MgCl2、Ba(OH)2、HNO3三种溶液混合:Mg2++2OH-=Mg(OH)2↓ C.CaCO3溶于醋酸:CaCO3+2CH3COOH=Ca2++2CH3COO-+CO2↑+H2O D.向海带灰浸出液中加入硫酸、双氧水:2I-+H2O2=2OH-+I2 |
|
| 14. 选择题 | 详细信息 |
常温下,HA的电离常数Ka=1×10-6,向20 mL浓度为0.01 mol·L-1的HA溶液中逐滴加入0.01mol·L-1的NaOH溶液,溶液的pH与加入NaOH溶液的体积之间的关系如图所示,下列说法正确的是( ) A.a点对应溶液的pH约为4,且溶液中只存在HA的电离平衡 B.b点对应溶液中:c(Na+)>c(A-)>c(HA)>c(H+)>c(OH-) C.d点对应溶液中:c(OH-)-c(H+)=c(A-) D.a、b、c、d四点对应的溶液中水的电离程度:a<b<c<d |
|
| 15. 选择题 | 详细信息 |
|
足量铜与一定量浓硝酸反应得到硝酸铜溶液和NO2、N2O4、NO 的混合气体,这些气体与1.68LO2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入5mol/LNaOH溶液至Cu2+恰好完全沉淀,则消耗NaOH溶液的体积是 A. 60mL B. 45mL C. 30mL D. 15mL |
|
| 16. 实验题 | 详细信息 |
通常状况下,CO是一种无色、无味、有毒的气体,难溶于水,与酸、碱、盐溶液均不反应。已知乙二酸晶体加热分解的方程式为:H2C2O4·2H2O (1)检验装置A气密性的方法是 (2)按气流方向连接各仪器,用数字表示接口的连接顺序: ①→ (3)证明CO存在的实验现象是 (4)本实验尾气处理的方法是 (5)根据题给的数据,假设各反应均充分发生且产生的气体全部排出,并与吸收液充分反应(提示:B、C中澄清石灰水均先变浑浊,后又变澄清),D中溶质及对应的物质的量是: 。 |
|
| 17. 填空题 | 详细信息 |
|
A、B、C、D、E、F六种短周期元素,其原子序数依次增大,其中B与C同周期,D与E和F同周期,A与D同主族,C与F同主族,C元素的原子最外层电子数是次外层电子数的三倍,D是所在周期原子半径最大的主族元素。又知六种元素所形成的常见单质在常温常压下有三种是气体,三种是固体。请回答下列问题: (1)元素D在周期表中的位置__________。 (2)C、D、F三种元素形成的简单离子的半径由大到小的顺序是(用离子符号表示)______。 (3)由A、B、C三种元素以原子个数比4∶2∶3形成化合物X,X中所含化学键类型有________________________________________________________________________。 (4)若E是金属元素,其单质与氧化铁反应常用于焊接钢轨,请写出反应的化学方程式:________________________________________________________________________。 若E是非金属元素,其单质在电子工业中有重要应用,请写出其氧化物溶于强碱溶液的离子方程式:_______________________________________________________________。 (5)FC2气体有毒,排放到大气中易形成酸雨,写出FC2与氧气和水蒸气反应的化学方程式______________________________________________________________________。 |
|
| 18. | 详细信息 |
废旧显示屏玻璃中含SiO2、Fe2O3、CeO2、FeO等物质。某课题小组以此玻璃粉末为原料,制得Ce(OH)4和硫酸铁铵矾[Fe2(SO4) 3·(NH4) 2SO4·24H2O],流程设计如下: 已知:Ⅰ.酸性条件下,铈在水溶液中有Ce3+、Ce4+两种主要存在形式,Ce4+有较强氧化性; Ⅱ.CeO2不溶于稀硫酸,也不溶于NaOH溶液。 回答以下问题: (1)滤渣A的主要成分是___。 (2)反应②中H2O2的作用是___。 (3)反应③的离子方程式是___。 (4)已知有机物HT能将Ce3+从水溶液中萃取出来,该过程可表示为:2Ce3+(水层)+6HT(有机层) (5)硫酸铁铵矾[Fe2(SO4) 3·(NH4) 2SO4·24H2O]广泛用于水的净化处理,其净水原理用离子方程式解释是___。 |
|
| 19. 填空题 | 详细信息 |
实现 “节能减排” 和“低碳经济”的一项重要课题就是如何将CO2转化为可利用的资源。目前工业上有一种方法是用CO2来生产燃料甲醇。一定条件下发生反应:CO2(g)+3H2(g) (1)关于该反应的下列说法中,正确的是_________(填字母)。 A.ΔH<0,ΔS<0 B.ΔH>0,ΔS<0 C.ΔH>0,ΔS>0 D.ΔH<0,ΔS>0 (2)为探究反应原理,现进行如下实验,在体积为l L的密闭容器中,充入l mol CO2和4 mol H2,一定条件下发生反应:CO2(g)+3H2(g) ①从反应开始到平衡,H2的平均反应速率v(H2)=________;CO2的转化率w(CO2)=________。 ②该反应的平衡常数K=_____________。(只列表达式和计算式,不必计算出结果) ③下列措施中能使化学平衡向正反应方向移动的是________________(填字母)。 A.将CH3OH(g)及时液化抽出 B.升高温度 C.选择高效催化剂 D.再充入l molCO2和4 molH2 (3)25℃,1.01×105Pa时,16 g 液态甲醇完全燃烧,当恢复到原状态时,放出350.8kJ的热量,写出该反应的热化学方程式:______________________。 (4)选用合适的合金为电极,以氢氧化钠、甲醇、水、氧气为原料,可以制成一种以甲醇为原料的燃料电池,其负极的电极反应式是:______________________。 |
|
| 20. 推断题 | 详细信息 |
3-苯基丙烯醛是一种被广泛应用在食品加工中的高效低毒食品添加剂,下列是用其合成聚酯F的路线示意图: 已知:RCHO 根据题意回答: (1)3-苯基丙烯醛分子中官能团的名称为___; (2)合成路线中的①、④两个步骤的目的是___。 (3)反应③的反应类型为___。 (4)若X为银氨溶液,则反应⑤的化学方程式为___。 (5)同时符合下列条件的D的同分异构体共有___种。 a.既可发生银镜反应又可发生水解 b.能与FeCl3溶液发生显色反应 c.是苯的二元取代物。 上述同分异构体中,核磁共振氢谱有峰面比为1:2:2:2:2:1的结构简式___。 |
|
最近更新



