四川省射洪中学校2020-2021年高二上册第二次月考化学题带参考答案
| 1. 选择题 | 详细信息 |
如图是s能级和p能级的原子轨道图,下列说法正确的是( )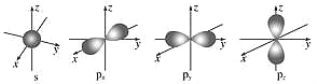 A.s能级和p能级的原子轨道形状相同 B.每个p能级都有6个原子轨道 C.钠原子的电子在11个原子轨道上高速运动 D.s能级的原子轨道半径与能层序数有关 |
|
| 2. 选择题 | 详细信息 |
|
化学与生活关系密切。下列关于能量及能源的说法,正确的是( ) A.物质燃烧放出的热量就是其燃烧热 B.恒容条件下,化学反应过程中的能量变化等于该反应前后体系的焓变 C.需要加热才能进行的化学反应不一定是吸热反应 D.太阳能、氢能、风能、核能、地热能都属于资源丰富、可以再生的未来新能源 |
|
| 3. 选择题 | 详细信息 |
|
下列有关元素及周期表说法错误的是 A.金属元素约占80% B.主族元素处于周期表的s区和p区 C.Na、K、Rb第一电离能逐渐增大 D.最外层为4s1的元素有3种 |
|
| 4. 选择题 | 详细信息 |
|
下列分子或离子的VSEPR模型与空间立体构型一致的是 A.BF3 B.NH3 C.H2O D.ClO3- |
|
| 5. 选择题 | 详细信息 |
|
下列化合物中共价键极性最弱的是( ) A.H2O B.H2S C.H2Te D.H2Se |
|
| 6. 选择题 | 详细信息 |
|
下列物质熔化或升华时,所克服的粒子间作用与晶体硅相同的是( ) A.碘升华 B.Mg熔化 C.蔗糖熔化 D.碳化硅熔化 |
|
| 7. 选择题 | 详细信息 |
|
某微粒的核外电子排布式为1s22s22p6,下列说法正确的是( ) A.可以确定该微粒为Ne B.对应元素一定位于元素周期表中第13列 C.它的单质不可能是强还原剂 D.对应元素可能是电负性最大的元素 |
|
| 8. 选择题 | 详细信息 |
|
用VSEPR模型预测下列分子或离子的立体结构,其中正确的是( ) A.BeCl2为V形 B.SO2为直线形 C.PCl3为正四面体形 D.CO |
|
| 9. 选择题 | 详细信息 |
|
下列有关比较不正确的是( ) A.电负性:Cl>S>P B.沸点:PH3<NH3<HF<NaOH C.最高正化合价:F>S>Si D.碱性:Mg(OH)2<NaOH<KOH |
|
| 10. 选择题 | 详细信息 |
|
下列说法正确的是( ) A.N2的电子式: B.基态碳原子的最外层电子轨道表达式: C.Zn2+的最外层电子排布式为3s23p63d10 D.比例模型  可以表示CH4分子,也可以表示CCl4分子 可以表示CH4分子,也可以表示CCl4分子 |
|
| 11. 选择题 | 详细信息 |
|
下列分子中所有原子都满足最外层8电子结构的是( ) A.CO2 B.BF3 C.HClO D.NH3 |
|
| 12. 选择题 | 详细信息 |
|
下列叙述中,正确的是( ) A.在同一能级上运动的电子,其运动状态肯定不同 B.白磷分子空间构型为正四面体,键角为109°28' C.11号到18号元素位于周期中同一周期,所以元素的电负性逐渐增大 D.固态时能导电的晶体一定是金属晶体 |
|
| 13. 选择题 | 详细信息 |
设NA为阿伏加德罗常数的值,下列叙述正确的是( )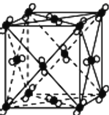 A.含16 g氧原子的二氧化硅晶体中含有的Si—O键的数目为4NA B.44 g干冰晶胞(如图所示)含有的CO2分子数为14NA C.标准状况下,22.4 L HF中含有NA个HF分子 D.S2和S8的混合物共64 g,其中所含硫原子数一定为2NA |
|
| 14. 选择题 | 详细信息 |
|
下列有关比较不正确的是( ) A.熔点:Mg<Al B.晶格能:CaO>NaCl C.晶体中阳离子配位数:CsCl<NaCl D.沸点:N2<CO |
|
| 15. 选择题 | 详细信息 |
|
甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是 ①CH3OH(g)+H2O(g)=CO2(g)+3H2(g)ΔH=+49.0kJ·mol-1 ②CH3OH(g)+ 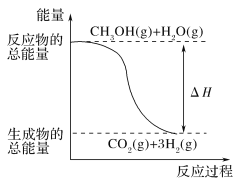 下列说法正确的是( ) A.CH3OH的燃烧热为192.9kJ∙mol-1 B.反应①中的能量变化如图所示 C.CH3OH转变成H2的过程一定要吸收能量 D.根据②推知反应CH3OH(l)+ |
|
| 16. 选择题 | 详细信息 |
|
下列有关实验现象、原理、方法和结论不正确的是( ) A.用红外光谱仪来测定分子的立体构型 B.向硫酸铜溶液中加入NaOH溶液,形成蓝色沉淀后再加入NaOH溶液,沉淀溶解,得到深蓝色溶液 C.用X-射线衍射实验来区分晶体和非晶体 D.向I2的CCl4溶液中加入浓KI水溶液,振荡试管,溶液紫色变浅,是由于在水溶液中发生反应:I2+I-=I |
|
| 17. 选择题 | 详细信息 |
|
现在四种晶体,其离子排列方式如图所示,其中化学式正确的是( ) A. AB2 B. EF2  C. XY3Z  D. AB3 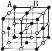 |
|
| 18. 选择题 | 详细信息 | ||||||||||||||||||
下列五种短周期元素的某些性质如表所示(其中只有W、Y、Z为同周期元素)
下列叙述错误的是( ) |
|||||||||||||||||||
| 19. 选择题 | 详细信息 |
|
下列说法正确的是( ) A.在稀溶液中,1molH2SO4(aq)与1molBa(OH)2(aq)完全反应所放出的热量为中和热 B.乙炔(C2H2)的燃烧热为1299.6kJ·mol-1,则2C2H2(g)+5O2(g)=4CO2(g)+2H2O(g)的ΔH=-2599.2kJ·mol-1 C.等质量的硫蒸气和硫粉分别完全燃烧,前者放出的热量更多 D.中和热化学方程式为:H+(l)+OH-(l)=H2O(l)ΔH=-57.3KJ/mol |
|
| 20. 选择题 | 详细信息 |
一种叠氮桥基配位化合物C的合成方法如图,下列叙述正确的是( ) A.基态Br价电子排布式为3d104s24p5 B.NaN3中N C.物质C中氮原子杂化形式有sp、sp2、sp3 D.CH3OH是手性分子 |
|
| 21. 选择题 | 详细信息 |
|
已知:① As(s)+ ② H2(g)+ ③ 2As(s)+ 则反应As2O5(s)+3H2O(l)=2H3AsO4(s)的ΔH为( ) A.2ΔH1-ΔH3-3ΔH2 B.ΔH3+3ΔH2-2ΔH1 C.ΔH3+3ΔH2-2ΔH1 D.2ΔH1-3ΔH2-ΔH3 |
|
| 22. 填空题 | 详细信息 |
下表是元素周期表短周期的一部分: 请按要求用化学用语回答下列问题: (1)元素④、⑥、⑨的离子半径由大到小的顺序为___; (2)用电子式表示元素④与元素⑥形成的化合物的形成过程___; (3)比元素⑦的原子序数多17的元素在周期表的位置为___; (4)写出由①④⑤三种元素组成的一种离子化合物的电子式___,若将其溶于水,破坏了其中的___(填“离子键”、“共价键”或“离子键和共价键”); (5)元素①和元素④形成的化合物及元素①和元素⑧形成的化合物均为18电子分子,请写出这两种化合物按物质的量之比4:1反应的离子方程式___。 |
|
| 23. 填空题 | 详细信息 |
|
请根据所学知识回答下列问题: (1)同温同压下,H2(g)+Cl2(g)=2HCl(g),在光照和点燃条件下的反应热(化学计量数相同)分别为ΔH1、ΔH2,ΔH1___ΔH2(填“>”“<”或“=”,下同)。 (2)已知常温时红磷比白磷稳定,比较下列反应中ΔH的大小:ΔH1___ΔH2。 ①4P(白磷,s)+5O2(g)=2P2O5(s)ΔH1 ②4P(红磷,s)+5O2(g)=2P2O5(s)ΔH2 (3)将X分别装入有水的锥形瓶里,立即塞紧带U形管的塞子,发现U形管内滴有红墨水的水面呈现如图所示状态。 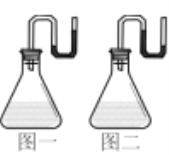 ①若X为金属氧化物,现象如图一所示,X可能是___(填化学式)。 ②若如图二所示,以下选项中与其能量变化相同的是___。 A.CO还原CuO的反应 B.CaCO3的分解反应 C.Al和Fe2O3的反应 (4)已知拆开1molH—H键、1molN—H键、1molN≡N键需要的能量分别是436kJ、391kJ、946kJ,则N2与H2反应生成NH3的热化学方程式为___。 (5)已知:H2(g)+ H2(g)+O2(g)=H2O2(l)ΔH2=-188kJ·mol-1 过氧化氢分解反应2H2O2(1)=2H2O(l)+O2(g)的ΔH=___kJ·mol-1。 |
|
| 24. | 详细信息 |
|
X、Y、Z、V、M、W为五种短周期元素,其中X是短周期元素中金属性最强的元素;Y与X同周期,是同周期简单离子中半径最小的;Z原子基态时2p原子轨道上有3个未成对的电子;V原子的核外电子排布式为1s22s22p63s2;M处于第三周期,其单质为淡黄色固体;W的一种同位素原子无中子。回答下列问题: (1)M与W形成的分子是___(填“极性分子”或“非极性分子”);与该分子互为等电子体的一种阴离子为(写化学式)___。 (2)元素X、Y、V第一电离能由小到大的顺序是___(用元素符号表示)。 (3)ZW3气体易溶于水的原因是___。(写两点) (4)M8是___晶体,该晶体中微粒间的作用力为___; (5)X的最高价氧化物的水化物和Y的最高价氧化物相互反应的离子方程式___。 |
|
| 25. 填空题 | 详细信息 |
|
金(79Au)是一种非常稳定的金属,但也可以形成多种化合物,并在化合物中呈一价或三价。 (1)已知Au的基态原子的价电子排布式为5d106s1,则Au位于周期表_____区。基态Au3+的价电子排布图为_______________。 (2)Au可以被王水溶解,其方程式为Au + HNO3 + 4HCl = H[AuCl4] + NO↑+ 2H2O ①NO3-的空间构型为______,H2O中心原子的杂化类型为_____; ②该反应中没有破坏的化学键有______。 a.金属键 b.离子键 c.共价键 d.氢键 e.极性键 f.非极性键 g.配位键 h.σ键 i.π键 (3)有一种化合物由Cs、Cl、Au三种元素组成,其晶胞如下。大灰球为Cs,小黑球为Cl,其余球为Au。 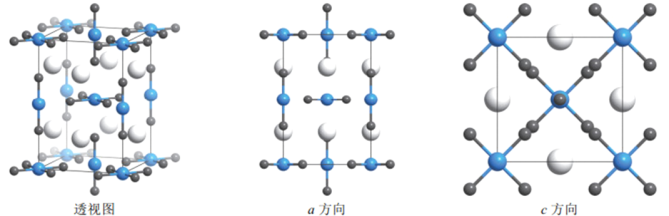 该化合物的化学式为_________,其中金原子有2种不同的化学环境,形成2种不同的配离子,它们分别是______和_______。 (4)金晶体(Au)是面心立方堆积,其晶胞参数为408 pm。已知阿伏伽德罗常数为NA。写出金晶体密度的计算式_____________g∙cm-3(不需要计算出结果)。 |
|
最近更新



