2018-2019年高一上册期末考试化学考题(贵州省麻江县一中)
| 1. 选择题 | 详细信息 |
|
下列反应不属于氧化还原反应的是 A. Zn+2HCl===ZnCl2+H2↑ B. Ca(ClO)2+2HCl===CaCl2+2HClO C. Pb3O4+8HCl(浓)===3PbCl2+Cl2↑+4H2O D. 3Cl2+6KOH(浓) |
|
| 2. 选择题 | 详细信息 |
|
下列反应的离子方程式中,正确的是 A. 稀硫酸滴在银片上:2Ag+2H+===2Ag++H2↑ B. 氧化铁与稀盐酸混合:Fe2O3+6H+===2Fe3++3H2O C. 碳酸钙溶于醋酸溶液中:CaCO3+2H+===Ca2++CO2↑+H2O D. 澄清石灰水与稀硝酸反应:Ca(OH)2+2H+===Ca2++2H2O |
|
| 3. 选择题 | 详细信息 |
|
下列有关电解质的叙述正确的是 A. 化合物都是电解质 B. 电解质一定是化合物 C. 难溶于水的化合物是非电解质 D. 溶于水能导电的物质是电解质 |
|
| 4. 选择题 | 详细信息 |
|
对四种无色溶液进行离子检验,实验结果如下,其中明显错误的是 A. K+、Na+、Cl-、NO3- B. K+、NO3-、OH-、HCO3- C. Na+、OH-、Cl-、NO3- D. MnO4-、K+、S2-、Na+ |
|
| 5. 选择题 | 详细信息 |
|
下列萃取与分液结合进行的操作(用CCl4为萃取剂,从碘水中萃取碘)中错误的是( ) A. 饱和碘水和CCl4加入分液漏斗中后,塞上上口部的塞子,用一手压住分液漏斗上口部,一手握住活塞部分,把分液漏斗倒转过来振荡 B. 静置,待分液漏斗中液体分层后,先使分液漏斗内外空气相通(准备放出液体) C. 打开分液漏斗的活塞,使全部下层液体沿盛接液体的烧杯内壁慢慢流出 D. 最后继续打开活塞,另用容器盛接并保存上层液体 |
|
| 6. 选择题 | 详细信息 |
|
不属于四种基本反应类型的氧化还原反应是 A. 2KMnO4 C. Fe+CuSO4===Cu+FeSO4 D. Fe2O3+3CO |
|
| 7. 选择题 | 详细信息 |
|
在制蒸馏水的实验中,下列叙述不正确的是 A. 在蒸馏烧瓶中盛约1/3体积的自来水,并放入几粒沸石 B. 冷水从冷凝管下口入,上口出 C. 冷水从冷凝管上口入,下口出 D. 收集蒸馏水时,应弃去开始馏出的部分液体 |
|
| 8. 选择题 | 详细信息 |
|
下列叙述中正确的是 A. 1 mol任何物质都含有6.02×1023个离子 B. 0.012 kg12C中含有约6.02×1023个碳分子 C. 1 mol水中含有2 mol氢和1 mol氧 D. 1 mol Ne中含有6.02×1024个电子 |
|
| 9. 选择题 | 详细信息 |
|
下列关于实验事故或药品的处理方法中,正确的是( ) A. 少量浓硫酸沾在皮肤上,立即用大量氢氧化钠溶液冲洗 B. 大量氯气泄漏时,用肥皂水浸湿毛巾捂住嘴和鼻,并迅速离开现场 C. 不慎洒出的酒精在桌上着火时,应立即用大量水扑灭 D. 金属钠着火时,可立即用沾水的毛巾覆盖 |
|
| 10. 选择题 | 详细信息 |
|
根据反应式:①Fe+Cu2+═Fe2++Cu ②2Fe3++Cu═2Fe2++Cu2+可判断离子的氧化性从强到弱的顺序是( ) A. Fe2+、Fe3+、Cu2+ B. Fe2+、Cu2+、Fe3+ C. Cu2+、Fe2+、Fe3+ D. Fe3+、Cu2+、Fe2+ |
|
| 11. 选择题 | 详细信息 |
|
在两个容积相同的容器中,一个盛有NH3,另一个盛有H2和O2的混合气体。在同温同压下,两容器内的气体不可能具有相同的 A. 原子数 B. 分子数 C. 质量 D. 电子数 |
|
| 12. 选择题 | 详细信息 |
|
下列反应的离子方程式不正确的是( ) A.铁与稀盐酸反应:2Fe+6H+=2Fe3++3H2↑ B.氢氧化钠溶液与盐酸反应:OH- +H+=H2O C.氯气与水反应:Cl2+H2O====H++ Cl-+ HClO D.氯化钡溶液与稀硫酸反应:Ba2++SO42-=BaSO4↓ |
|
| 13. 选择题 | 详细信息 |
|
有NO、CO2、N2O4三种气体,它们分别都含有0.5 mol氧原子,则三种气体的物质的量之比为 A. 1∶1∶2 B. 1∶1∶1 C. 4∶2∶1 D. 1∶2∶4 |
|
| 14. 选择题 | 详细信息 |
|
一定条件下,氨气与一氧化氮发生反应4NH3+6NO=5N2+6H2O。该反应中化合价降低的元素是 A. NH3中的N B. NO中的O C. NO中的N D. NH3中的H |
|
| 15. 选择题 | 详细信息 |
|
已知气体的摩尔质量越小,扩散速度越快。右图所示为气体扩散速度的实验,两种气体扩散相遇时形成白色烟环。下列关于甲、乙的判断正确的是( ) C.甲是浓氨水,乙是浓盐酸 D.甲是浓硝酸,乙是浓氨水 |
|
| 16. 选择题 | 详细信息 |
|
常温下单质硫主要以S8形式存在。加热时,S8会转化为S6、S4、S2等。当温度达到750 ℃时,硫蒸气主要以S2形式存在(占92%)。下列说法中正确的是 A. S8转化为S6、S4、S2属于物理变化 B. 不论哪种硫分子,完全燃烧时都生成二氧化硫 C. S2、S4、S6、S8都是硫元素形成的单质,为同种物质 D. 把硫单质在空气中加热到750℃即得S2 |
|
| 17. 选择题 | 详细信息 |
|
关于地壳中含量占第一位和第二位的元素之间形成的化合物,有关其说法正确的是 A. 化学性质不活泼 B. 可溶于水且显酸性 C. 熔沸点较低,物理性质与CO2相似 D. 是酸性氧化物,不溶于任何酸 |
|
| 18. 选择题 | 详细信息 |
|
向下列溶液中滴加稀硫酸生成白色沉淀,继续滴加稀硫酸,沉淀溶解的是 A. Na2SiO3 B. BaCl2 C. FeCl3 D. NaAlO2 |
|
| 19. 选择题 | 详细信息 |
|
100 mL 2 mol/L的稀盐酸与一定量的锌充分反应,锌全部溶解,生成的氢气在标准状况下体积为1.12 L,设反应后溶液的体积仍为100 mL,则反应后溶液中H+的物质的量的浓度为 A. 1.5mol/L B. 1mol/L C. 0.5mol/L D. 0.25mol/L |
|
| 20. 选择题 | 详细信息 |
|
下列关于水泥和普通玻璃工业生产的叙述正确的是 ①产品都是硅酸盐 ②反应条件都是高温 ③都用含有硅的物质作原料 ④反应原理都是一系列复杂的物理化学变化 A. ①③ B. ①②③ C. ①③④ D. ①②③④ |
|
| 21. 选择题 | 详细信息 |
|
把二氧化硫通入硝酸铁溶液中,溶液由黄色变为浅绿色,但立即又变为黄色,此时若滴入氯化钡溶液,则会产生白色沉淀。在上述一系列变化过程中,最终被还原的是 A. SO2 B. NO3- C. Fe3+ D. Fe2+ |
|
| 22. 选择题 | 详细信息 |
|
下列各项比较中,正确的是 A. 熔点:金属钠<钠钾合金 B. 导电性:银<铜 C. 硬度:硬铝<铝 D. 延展性:生铁<纯金 |
|
| 23. 选择题 | 详细信息 |
|
关于氨的喷泉实验形成的原理解释正确的是 A. 氨水呈碱性 B. 氨气极易溶于水,烧瓶内外形成压强差 C. 氨气易液化 D. 氨气溶于水后形成的溶液易挥发 |
|
| 24. 选择题 | 详细信息 |
|
对于下列金属的叙述不正确的是 A. 在点燃镁、铝之前,应先用砂纸打磨,除去表面的氧化膜 B. 用砂纸打磨的铝条,放在酒精灯上加热至熔化,铝会滴落下来 C. 铁在氧气中燃烧生成的氧化物的主要成分是四氧化三铁 D. 金属单质在自然界中多以化合态的形式存在,因为它们大多有较强的还原性 |
|
| 25. 选择题 | 详细信息 |
某实验过程如图所示:则图③的试管中的现象是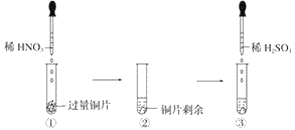 A. 无明显现象,因稀硫酸不与铜反应 B. 铜片溶解,产生无色气体,该气体遇到空气不变色 C. 铜片溶解,放出红棕色有刺激性气味的气体 D. 铜片溶解,产生无色气体,该气体在试管口变为红棕色 |
|
| 26. 选择题 | 详细信息 |
|
生活中常用来固定房门的“门吸”,它由磁铁和金属块两部分组成。该金属块能被磁铁所吸引,是因为可能含有以下材料中的 A. 银 B. 铁 C. 铝 D. 锌 |
|
| 27. 选择题 | 详细信息 |
|
在炼铁、制玻璃、制水泥三种工业生产中,都需要的原料是( )。 A.纯碱 B.石灰石 C.石英 D.粘土 |
|
| 28. 实验题 | 详细信息 |
|
实验室用密度为1.84 g/cm3、溶质的质量分数为98 %的硫酸,配制250 mL物质的量浓度为0.46 mol/L的硫酸。 (1)98 %的浓硫酸的物质的量浓度为_________。 (2)现有下列几种规格的量筒,应选用______(填序号)。 ①5 mL量筒 ②10 mL量筒 ③50 mL量筒 ④100 mL量筒 (3)实验需要以下步骤: ①定容②量取③摇匀④洗涤⑤转移⑥冷却⑦计算⑧装瓶⑨稀释进行顺序为_______。 (4)下列操作使所配溶液的物质的量浓度偏高的是__________。 A.往容量瓶中转移溶液时有少量液体溅出 B.未洗涤稀释浓H2SO4的小烧杯 C.定容时俯视刻度线 D.洗净容量瓶未干燥即用来配制溶液 E.定容后塞上瓶塞反复摇匀,静置后,液面不到刻度线,再加水至刻度线 |
|
| 29. 填空题 | 详细信息 |
|
(1)等温、等压下,等体积的O2和O3所含分子个数比______,质量比为_______。 (2)已知16 g A和20 g B恰好完全反应生成0.04 mol C和31.76 g D,则C的摩尔质量为_____。 (3)在三个密闭容器中分别充入Ne、H2、O2三种气体,当它们的温度和密度都相同时,这三种气体的压强(p)分别用p(Ne)、p(H2)、p(O2)表示,由大到小的顺序是____________。 |
|
| 30. 实验题 | 详细信息 |
为验证卤素单质氧化性的相对强弱,某小组用下图所示装置进行实验(夹持仪器已略去,气密性已检验)。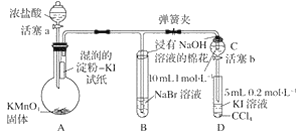 实验过程: Ⅰ.打开弹簧夹,打开活塞a,滴加浓盐酸。 Ⅱ.当B和C中的溶液都变为黄色时,夹紧弹簧夹。 Ⅲ.当B中溶液由黄色变为棕红色时,关闭活塞a。 Ⅳ.…… (1)验证氯气的氧化性强于碘的实验现象是_________________________________________。 (2)B中溶液发生反应的离子方程式是____________________________________________。 (3)为验证溴的氧化性强于碘,过程Ⅳ的操作和现象是________________________________。 (4)过程Ⅲ实验的目的是_________________________________________________________。 |
|
| 31. 填空题 | 详细信息 |
|
有M、N两种溶液,经测定这两种溶液中含有下列12种离子:Al3+、Cl-、Na+、K+、NO3-、OH-、Fe2+、AlO2-、CO32-、NH4+、SO42-、H+。 (1)完成下列表格中实验①的结论和实验②的实验内容以及现象:_____________、_________________  (2)根据(1)中的实验回答: NO3-存在于________溶液中,理由是___________________________________________; Cl-存在于________溶液中,理由是__________________________________________。 (3)根据(1)中的实验确定,M溶液中含有的离子为__________________________________ |
|
| 32. 填空题 | 详细信息 |
某化学课外小组所做实验的示意图如图所示:图中“→”表示气体流向, M是一种纯净而干燥的气体,Y为另一种气体,E内有红棕色气体产生,实验所用物质只能由下列物质中选取:Na2CO3、Na2O2、NaCl、Na2O、CaCl2、(NH4)2CO3、碱石灰等固体及蒸馏水。据此实验,完成下列填空: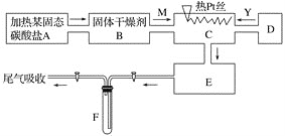 (1)A中所用装置的主要仪器和药品是______________________。 (2)B中所选的干燥剂是________,其作用是______________________________。 (3)C中发生的主要反应的化学方程式:________________________________。 (4)制取Y气体的D装置所用的主要仪器是__________________________。 制取Y气体的化学方程式是________________________。 (5)F中发生反应的化学方程式为__________________________。 |
|
| 33. 实验题 | 详细信息 |
|
实验室制取氨气通常有两种方法: ①用固体氢氧化钙与氯化铵共热; ②在常温下用固体氢氧化钠与浓氨水反应。 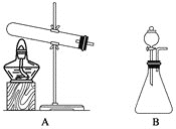 (1)上面的制取装置图中,方法①应选用装置__________(填“A”或“B”,下同);方法②应选用装置__________。 (2)加热氯化铵与氢氧化钙混合物制取氨气的反应方程式是________________。 (3)在制取后,如果要干燥氨气,应选用的干燥剂是________________(填字母)。 A.浓硫酸 B.碱石灰 C.五氧化二磷 (4)检验集气瓶中是否收集满氨气的方法是__________________________。 |
|
最近更新



