广西2019年高二化学上册月考测验在线做题
| 1. 选择题 | 详细信息 |
|
下列选项中,键的极性相同,分子极性也相同的是( ) A. |
|
| 2. 选择题 | 详细信息 |
|
关于化学式[TiCl(H2O)5]Cl2·H2O的配合物的下列说法中正确的是( ) A. 配位体是Cl-和H2O,配位数是9 B. 中心离子是Ti4+,配离子是[TiCl(H2O)5]2+ C. 内界和外界中的Cl的数目比是1∶2 D. 加入足量AgNO3溶液,所有Cl-均被完全沉淀 |
|
| 3. 选择题 | 详细信息 |
|
下列表达方式或说法正确的是 ( ) A. CO2 分子模型示意图: B. 氯化铵的电子式:  C. 硫离子的核外电子排布式 1s22s22p63s23p4 D. NH3、H2O、CO2三分子中中心原子上孤电子对数最多的是H2O |
|
| 4. 选择题 | 详细信息 |
|
据某科学杂志报道,国外有一研究发现了一种新的球形分子,它的分子式为C60Si60,其分子结构好似中国传统工艺品“镂雕”,经测定其中包含C60,也有Si60结构。下列叙述正确的是( ) A. 该物质有很高的熔点、很大的硬度 B. 该物质形成的晶体属分子晶体 C. 该物质分子中Si60被包裹在C60里面 D. 该物质的摩尔质量为2400 |
|
| 5. 选择题 | 详细信息 |
|
根据VSEPR模型判断,下列微粒中所有原子都在同一平面上的是( ) A. SO32- 和NO2- B. NO3- 和SO32- C. |
|
| 6. 选择题 | 详细信息 |
|
如图是某同学画出的基态氮原子核外电子排布图。下列判断正确的是( ) A. 正确,符合核外电子排布规律 B. 错误,违背了“能量最低原理” C. 错误,违背了“泡利原理” D. 错误,违背了“洪特规则” |
|
| 7. 选择题 | 详细信息 |
|
已知X、Y元素同周期,且电负性X>Y,下列说法错误的是( ) A. X与Y形成化合物时,X可以显负价,Y显正价 B. 第一电离能可能Y小于X C. 最高价含氧酸的酸性:X对应的酸性弱于Y对应的 D. 气态氢化物的稳定性:HmY小于HmX |
|
| 8. 选择题 | 详细信息 |
|
已知下列电子排布图所表示的是元素的原子,其中能量处于最低状态的是( ) A. B. C. D. |
|
| 9. 选择题 | 详细信息 |
|
下列有关共价键键参数的的比较中,不正确的是( ) A. 键能:C—N < C=N < C≡N B. 键长:I—I > Br—Br > Cl—Cl C. 分子中的键角:H2O > NH3 D. 乙烯分子中碳碳键的键能:σ键 > π键 |
|
| 10. 选择题 | 详细信息 |
|
下列现象与氢键有关的是( ) ①NH3的熔、沸点比ⅤA族其他元素的氢化物高 ②小分子的醇、羧酸可以和水以任意比互溶 ③冰的密度比液态水的密度小 ④尿素的熔、沸点比醋酸的高 ⑤邻羟基苯甲酸的熔、沸点比对羟基苯甲酸的低 ⑥水分子高温下也很稳定 A. ①②③④⑤⑥ B. ①②③④⑤ C. ①②③④ D. ①②③ |
|
| 11. 选择题 | 详细信息 |
|
下列微粒半径大小比较正确的是( ) A. N |
|
| 12. 选择题 | 详细信息 |
|
下列有关晶体的叙述中错误的是 A. 石墨的层状结构中由共价键形成的最小的碳环上有六个碳原子 B. 氯化钠晶体中每个Na+周围紧邻的有6个Cl— C. CsCl晶体中每个Cs+周围紧邻的有8个Cl—,每个Cs+周围等距离紧邻的有6个Cs+ D. 在面心立方最密堆积的金属晶体中,每个金属原子周围紧邻的有4个金属原子 |
|
| 13. 选择题 | 详细信息 |
2008年秋天,毒奶粉事件震惊全国,这主要是奶粉中含有有毒的三聚氰胺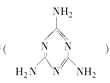 。下列关于三聚氰胺分子的说法正确的是 。下列关于三聚氰胺分子的说法正确的是A. 所有碳原子采用sp3杂化,所有氮原子采用sp3杂化 B. 一个分子中共含有15个σ键 C. 属于极性分子,故极易溶于水 D. 分子内既有极性键又有非极性键 |
|
| 14. 选择题 | 详细信息 |
|
在以离子键为主的化学键中常含有共价键的成分,两种元素的电负性差异越小,其共价键成分越大。下列各对原子形成的化学键中共价键成分最多的是( ) A. K与F B. Na与Cl C. Al与S D. Mg与Cl |
|
| 15. 选择题 | 详细信息 |
|
氮化铝(AlN)常用做砂轮及高温炉衬材料,熔化状态下不导电,可知它属于( ) A.离子晶体 B.原子晶体 C.分子晶体 D.无法判断 |
|
| 16. 选择题 | 详细信息 |
|
下列各选项所述的两个量,前者一定大于后者的是 ①3d轨道的能量和4s轨道的能量;②同一电子层中第一个p轨道与第二个p轨道的能量;③2s和3s的轨道半径;④同一原子的基态和激发态;⑤F元素和O元素的电负性;⑥Mg元素和Al元素的第一电离能;⑦H原子和H+离子的半径 A. ①⑤⑥⑦ B. ②③⑤ C. ②④⑦ D. 全对 |
|
| 17. 选择题 | 详细信息 |
|
下列各组晶体物质中,化学键类型相同,晶体类型也相同的是 ( ) ①SiO2和SO3 ②晶体硼和HCl ③CO2和SO2 ④晶体硅和金刚石 ⑤晶体氖和晶体氮 ⑥硫黄和碘 A. ①②③ B. ④⑤⑥ C. ③④⑥ D. ①③⑤ |
|
| 18. 实验题 | 详细信息 |
已知非金属单质硫(S)是淡黄色固体粉末,难溶于水。为了验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验,请回答下列问题: (1)请写出A装置中发生反应的化学方程式_____。 (2)饱和食盐水的作用是_____。 (3)装置B中盛放的试剂是_____(选填下列所给试剂的代码),反应离子方程式是_____。 A.N (4)还有哪些事实能够说明氯元素的非金属性比硫元素的非金属性强_____(填编号) ①HCl比 (5)此装置有多种用途,若用此装置验证氯元素的非金属性比碘元素的强,需要在B装置中加入KI溶液,通入一段时间气体后向B中加入少量CC |
|
| 19. | 详细信息 |
铝元素在自然界中主要存在于铝土矿(主要成分为A (1)在滤液A中加入漂白液,目的是氧化除铁,便于后期形成Fe(OH ①检验滤液A中含有F ②检验滤液B中不含有F ③将滤液B中的铝元素以沉淀形式析出,可选用的最好试剂为_____(填选项编号)。 a.氢氧化钠溶液 b.硫酸溶液 c.二氧化碳 d.氨水 (2)矿渣中一定含有的物质是_____(填化学式)。焙烧制备硅酸钠,可采用的装置为_____(填选项编号)。  |
|
| 20. 综合题 | 详细信息 |
|
草酸( (1) A 恒容时,容器的压强不再变化,说明该反应已达到化学平衡状态 B 恒压时,容器的体积不再变化,说明该反应已达到化学平衡状态 C 气体摩尔体积不再发生变化,说明该反应已达到化学平衡状态 D 气体平均摩尔质量不再发生变化,说明该反应已达到化学平衡状态 E 气体总质量不再发生变化,说明该反应已达到化学平衡状态 (2)草酸分解所需燃料可以是CO,通过甲烷制备CO:C ①平衡时,该反应的平均反应速率v(C ②在不改变反应混合物用量的前提下,为了提高C (3)草酸( ①当V=10mL时,溶液中H ② 当V=a mL时,溶液中离子浓度有如下关系:c(  (4)电解饱和草酸溶液可以制得高档香料乙醛酸( |
|
| 21. 综合题 | 详细信息 |
|
能源、材料和信息是现代社会的三大“支柱”。 (1)目前,利用金属或合金储氢的研究已取得很大进展,图是一种镍基合金储氢后的晶胞结构图.  ①Ni原子的价电子排布式是_____。 ②该合金储氢后,含1mol La的合金可吸附 (2)南师大结构化学实验室合成了一种多功能材料--对硝基苯酚水合物(化学式为 ①晶体中四种基本元素的电负性由大到小的顺序是_____。 ②对硝基苯酚水合物失去结晶水的过程中,破坏的微粒间作用力是_____。 (3)科学家把NaN |
|
最近更新



