七校联盟2019年高一化学上半期期中考试网络考试试卷
| 1. 选择题 | 详细信息 |
|
化合反应、分解反应、置换反应和复分解反应是四种基本化学反应类型。下列变化属于氧化还原反应,但是不属于四种基本反应类型的是 A. CO+CuO C. 2O3 |
|
| 2. 选择题 | 详细信息 |
|
下列叙述中正确的是( ) A. CO2是酸性氧化物 B. 由一种元素组成的物质一定是单质 C. 单质只能用置换反应制取 D. 含氧元素的化合物称为氧化物 |
|
| 3. 选择题 | 详细信息 |
|
下列说法不正确的是 A. 氢气的摩尔质量是2g/mol B. 摩尔是物质的量的单位 C. 1molOH—的质量是17g D. 1mol气体所占的体积约为22.4L |
|
| 4. 选择题 | 详细信息 |
|
448mL某气体在标准状况下的质量为1.28g,该气体的摩尔质量约为 A. 64g B. 64 C. 64g·mol-1 D. 32g·mol-1 |
|
| 5. 选择题 | 详细信息 |
|
若aAn+与bB2-两种离子的核外电子层结构相同,则a等于 A. b+n-2 B. b+n+2 C. b-n-2 D. b-n+2 |
|
| 6. 选择题 | 详细信息 |
|
有关电解质的说法正确的是 A. NaOH固体溶于水后能导电,所以NaOH是电解质 B. CO2水溶液的能够导电,所以CO2是电解质 C. 液态的铜导电性很好,所以铜是电解质 D. FeCl3溶液能够导电,所以FeCl3溶液是电解质 |
|
| 7. 选择题 | 详细信息 |
|
下列叙述与胶体知识无关的是 A. 分散质粒子直径在1-100nm 之间 B. 明矾可用作净水剂 C. 在电影院看电影,会看到从放映室到银幕的光柱 D. 向氯化铁溶液中加入过量氢氧化钠溶液会看到红褐色沉淀 |
|
| 8. 选择题 | 详细信息 |
|
下列方法(必要时可加热)不合理的是 A. 用澄清石灰水鉴别CO和CO2 B. 用水鉴别苯和四氯化碳 C. 用Ba(OH)2溶液鉴别NH4Cl、(NH4)2SO4和K2SO4 D. 用淀粉碘化钾试纸鉴别碘水和溴水 |
|
| 9. 选择题 | 详细信息 |
|
下列实验操作中,错误的是 A. 分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 B. 蒸馏时,应使温度计水银球位于蒸馏烧瓶支管处 C. 萃取时,应选择有机萃取剂,且萃取剂的密度必须比水大 D. 蒸发时,蒸发皿中出现大量固体时即停止加热 |
|
| 10. 选择题 | 详细信息 |
|
用洁净的铂丝蘸取某无色溶液,放在无色火焰上灼烧,透过蓝色钴玻璃,火焰的颜色呈紫色,下列说法正确的是 A. 该溶液中阳离子只有钾离子 B. 该溶液中一定含有钠离子 C. 该溶液中可能含有钠离子,但一定含有钾离子 D. 该溶液中可能含有钾离子,但一定含有钠离子 |
|
| 11. 选择题 | 详细信息 |
|
下列物质中含原子个数最多的是 A. 0.4 mol氧气 B. 4℃时,5.4 mL H2O C. 标准状况下5.6 L二氧化碳 D. 10 g氖气 |
|
| 12. 选择题 | 详细信息 |
|
下列含氯化合物中,不能由金属单质和氯气直接反应得到的是 A. FeCl2 B. CuCl2 C. AlCl3 D. MgCl2 |
|
| 13. 选择题 | 详细信息 |
|
同温同压下,等物质的量的SO2和CO2相比较,下列叙述正确的是 A.质量比为11:16 B.密度比为11:16 C.体积比为11:16 D.分子个数比为1:1 |
|
| 14. 选择题 | 详细信息 |
|
关于氯气的叙述中,下列正确的是 A. 干燥的氯气可以贮存在钢瓶中 B. 氯气在自然界中既可以以化合态存在,也可以以游离态存在 C. 氯气不能溶解于水,所以可用排水法收集氯气 D. 氯气、氯水、液氯是同一种物质,只是状态不同,都属于纯净物 |
|
| 15. 选择题 | 详细信息 |
|
在反应3Cl2+2FeBr2===2FeCl3+2Br2中被氧化的元素是 A. Fe B. Cl C. Fe和Br D. Br |
|
| 16. 选择题 | 详细信息 |
|
能用来区别NaCl、 NaBr、KI三种无色溶液的试剂是 A. AgNO3溶液 B. CCl 4 C. 苯 D. 溴水和淀粉 |
|
| 17. 选择题 | 详细信息 |
下图是一种检验某气体化学性质的实验装置,图中B为开关,如先打开B,在A处通入干燥氯气,C中红色布条颜色无变化,当关闭B时,C处红色布条颜色褪去。则D瓶中盛有的溶液是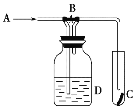 A. 浓H2SO4溶液 B. 浓NaOH溶液 C. 饱和NaCl溶液 D. 浓NaBr溶液 |
|
| 18. 选择题 | 详细信息 |
|
下列说法正确的是 A. 含有NA个氦原子的氦气在标准状况下的体积约为11.2L B. 25℃,1.01×105Pa,64gSO2中含有的原子数为3NA C. 在常温常压下,11.2L Cl2含有的分子数为0.5NA D. 标准状况下,11.2LH2O含有的分子数为0.5NA |
|
| 19. 选择题 | 详细信息 |
|
下列溶液中含Cl-浓度最大的是( ) A. 10m1,0.1mol·L-1的AlC13溶液 B. 20m1,0.1mo1·L-1的CaC12溶液 C. 30m1,0.2mo1·L-1的KC1溶液 D. 100m1,0.25mo1·L-1的NaC1溶液 |
|
| 20. 选择题 | 详细信息 |
|
实验室用KClO3分解(MnO2做催化剂)制取氧气,实验后回收剩余固体中的MnO2,正确的操作步骤是 A. 溶解、过滤、蒸发 B. 溶解、过滤、洗涤、干燥 C. 溶解、过滤、结晶 D. 溶解、结晶、干燥 |
|
| 21. 选择题 | 详细信息 |
|
将0.2 mol MnO2和50 mL 12 mol/L盐酸混合后缓缓加热,反应完全后向留下的溶液中加入足量AgNO3溶液,生成AgCl沉淀物质的量为(不考虑盐酸的挥发) A. 等于0.3 mol B. 小于0.3 mol C. 大于0.3 mol D. 以上结论都不正确 |
|
| 22. 计算题 | 详细信息 |
| 12.4 g Na2X含有0.4 mol Na+,Na2X的摩尔质量为______________,X的相对原子质量为__________,该物质的化学式为_______________。 | |
| 23. 填空题 | 详细信息 |
|
有甲、乙、丙三种元素,甲元素M层的电子数是其K层的电子数的1/2,乙元素原子核内无中子,丙元素原子核内有8个质子。 ①写出丙元素的元素符号_____________。 ②写出甲、乙、丙三种元素组成的化合物在水中的电离方程式___________________。 ③画出甲元素的原子结构示意图_______________。 |
|
| 24. 填空题 | 详细信息 |
|
高锰酸钾和浓盐酸可以发生下列反应:2KMnO4+16HCl(浓)===5Cl2↑+2MnCl2+2KCl+8H2O (1)用双线桥法表示此反应的电子转移的方向及数目_____________ (2)该反应的氧化剂是______,还原剂是________。HCl表现 ___________性和 ____性。 (3)若消耗0.2 mol氧化剂,转移电子的物质的量是________ mol。生成氯气在标准状况下的体积是__________ |
|
| 25. 实验题 | 详细信息 |
实验室常用二氧化锰和浓盐酸共热的方法制取氯气。根据要求回答下列问题。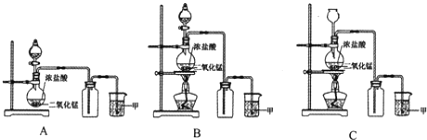 (1)A、B、C三套装置中,应选用的装置是____________(选填“A”、“B”、“C”); (2)写出制取氯气的化学方程式_________________________________________。 (3)为了防止氯气污染环境,图中溶液甲中发生的化学反应方程式___________________。 (4)由于氯气贮存运输不方便,工业上常将氯气转化为漂白粉,工业上生产漂白粉的主要化学方程式是_____________________,在空气中漂白粉长期存放会变质而失效的原理是(用化学方程式说明) ___________________________________________________ 。 |
|
| 26. 实验题 | 详细信息 |
|
实验室要配制0.1mol/L的稀硫酸480mL,回答下列问题: (1)需要98%密度为1.84g/cm3的浓硫酸 ______ mL (2)配制时,必须使用的仪器有 ______ (填代号) 还缺少的仪器是 ______、______ 。 ①烧杯 ②10 mL量筒 ③20 mL量筒 ④托盘天平(带砝码) ⑤玻璃棒 (3)配制时,该实验两次用到玻璃棒,其作用分别是______、 ______ 。 (4)配制过程中出现以下情况,对所配溶液浓度有何影响(填“偏高”“偏低”“不影响”) ①用量筒量取98%的硫酸时俯视。(_________) ②容量瓶没有干燥。(______) |
|
最近更新



