2019-2020年高一9月月考化学考题考题(河南省鲁山县第一高级中学)
| 1. 选择题 | 详细信息 |
|
下列实验操作中,不能用于物质分离的是( ) A.  B. B. C.  D. D. |
|
| 2. 选择题 | 详细信息 |
|
下列电离方程式或离子方程式不正确的是( ) A.NaOH电离:NaOH=Na++OH- B.CaCl2电离:CaCl2=Ca2++2Cl- C.溴水滴入KI溶液中,Br2+2I-=2Br-+I2 D.CaCO3溶解于盐酸中:CO32-+2H+=CO2↑+H2O |
|
| 3. 选择题 | 详细信息 |
|
密度为d g/mL 的溶液V mL,含有摩尔质量 Mg/mol 的溶质 mg,其物质的量浓度为c mol/L,质量分数为W%,下列表示式不正确的是 A. c=1000m/VM B. m=d∙V∙W/100 C. d=cM/10W D. W%=(cM/1000d)% |
|
| 4. 选择题 | 详细信息 | ||||||||||||||||||||
下表中物质的分类组合完全正确的是( )
|
|||||||||||||||||||||
| 5. 选择题 | 详细信息 |
在如图所示电解质溶液的导电性装置中,若向某一电解质溶液中滴加另一种溶液或通入某种气体时,则灯光由亮变暗至熄灭后又逐渐变亮的是( )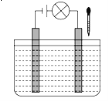 A.盐酸中逐滴加入食盐溶液 B.醋酸中逐滴加入氢氧化钠溶液 C.饱和石灰水中不断通入CO2 D.醋酸中逐滴加入氨水 |
|
| 6. 选择题 | 详细信息 |
|
设NA表示阿伏加德罗常数的值,下列说法正确的是( ) A.标准状况下,0.1 NA个水分子所占的体积约为2.24 L B.11.2 L CO2气体的分子数为0.5 NA C.NH3的摩尔质量等于NA个氨分子的质量之和 D.101 kPa、4 ℃时,18 mL水和202 kPa、27 ℃时32 g O2所含分子数均为NA |
|
| 7. 选择题 | 详细信息 |
|
下列各组物质按照电解质、非电解质、单质、混合物顺序排列的一项是( ) A.HCl、SO3、石墨、液氧 B.NaCl、CO2、铁、空气 C.蔗糖、CuSO4、氮气、NaCl溶液 D.KCl、NaNO3、氧气、石灰水 |
|
| 8. 选择题 | 详细信息 |
|
下列各组离子中的离子,能在溶液中大量共存的是 A.Na+、Mg2+、Cl-、OH- B.H+、Ca2+、CO32-、NO3- C.Cu2+、K+、SO42-、NO3- D.Na+、HCO3- 、OH-、Ca2+ |
|
| 9. 选择题 | 详细信息 |
|
下列实验操作正确的是( ) A. 加入盐酸以除去硫酸钠中的少量碳酸钠杂质 B. 配制溶液定容时,用胶头滴管滴加蒸馏水至溶液凹液面最低点与刻度线相切 C. 用分液漏斗分离液体时,先放出下层液体后,再放出上层液体 D. 萃取时,将酒精和碘化钾溶液放入分液漏斗中静置 |
|
| 10. 选择题 | 详细信息 |
|
下列实验操作中正确的是 A.配制一定物质的量浓度的硫酸溶液时,用量筒量取一定体积的浓硫酸倒入烧杯后,再用蒸馏水洗涤量筒2~3次,并将洗涤液一并倒入烧杯中稀释 B.玻璃导管蘸水后,边旋转边向橡皮管中插入 C.用胶头滴管向试管中加入液体时,为防止滴在试管外面,应将滴管尖嘴处伸入试管口中 D.称量氢氧化钠固体的质量时,将称量物放在纸片上,并置于托盘天平的左盘,砝码放在托盘天平的右盘。 |
|
| 11. 选择题 | 详细信息 |
|
下列分散系最不稳定的是( ) A. 向CuSO4溶液中加入NaOH溶液得到的分散系 B. 向水中加入食盐得到的分散系 C. 向沸水中滴入饱和FeCl3溶液得到的红褐色液体 D. 向NaOH溶液中通入CO2得到的无色溶液 |
|
| 12. 选择题 | 详细信息 |
|
下列现象或新技术的应用中,不涉及胶体性质的是( ) A. 在饱和氯化铁溶液中滴加NaOH溶液,产生红褐色沉淀 B. 使用微波手术刀进行外科手术,可使开刀处的血液迅速凝固而减少失血 C. 清晨,在茂密的树林中,常常可以看到枝叶间透过的一道道光柱 D. 河流入海口形成三角洲 |
|
| 13. 选择题 | 详细信息 |
|
36.5g氯化氢溶解在1L水中(水的密度近似为1g·mL-1),所得溶液的密度为ρg·mL-1,质量分数为w,物质的量浓度为cmol·L-1,NA表示阿伏加德罗常数的值,则下列叙述正确的是( ) A. 所得溶液的物质的量浓度为1mol·L-1 B. 36.5g氯化氢含有NA个原子 C. 36.5gHCl气体占有的体积约为22.4L D. 所得溶液的质量分数w=36.5c/1000ρ |
|
| 14. 选择题 | 详细信息 |
|
下列说法正确的一组是 ①不溶于水的盐都是弱电解质 ②可溶于水的盐都是强电解质 ③0.5 mol/L的一元酸溶液中H+浓度为0.5 mol/L ④强酸溶液中的H+浓度一定大于弱酸溶液中的H+浓度 ⑤电解质溶液导电的原因是溶液中有自由移动的阴阳离子 ⑥熔融的电解质都能导电 A. ①③⑤⑥ B. ②④⑤⑥ C. 只有⑤ D. 只有⑥ |
|
| 15. 选择题 | 详细信息 |
|
配制250 mL 0.1 mol·L-1的盐酸时,下列实验操作使所配溶液浓度偏大的是 A. 用量筒量取所需的浓盐酸时俯视刻度线 B. 定容时仰视刻度线 C. 用量筒量取所需浓盐酸倒入烧杯后,用水洗涤量筒2~3次,洗涤液倒入烧杯中 D. 定容后倒转容量瓶几次,发现凹液面最低点低于刻度线,再补加几滴蒸馏水 |
|
| 16. 选择题 | 详细信息 |
|
下列对相等物质的量的C3H6和C2H4(两种物质标准状况下均为气体)的比较中正确的是( ) ①所含的分子数目之比为1∶1 ②相同条件下体积之比为1∶1③所含的原子总数目之比为2∶3 ④相同条件下密度之比为2∶3 A.①③ B.②③ C.①② D.③④ |
|
| 17. 选择题 | 详细信息 |
|
由CO2、CO、H2组成的混合气体在同温同压下与氮气的密度相同,则该混合气体中CO2、H2、CO的体积比可为( ) A. 13∶8∶29 B. 22∶1∶14 C. 29∶8∶13 D. 13∶16∶57 |
|
| 18. 选择题 | 详细信息 |
|
在NaCl、MgCl2、MgSO4形成的混合溶液中,c(Na+)=0.10mol·L-1,c(Mg2+)=0.25mol·L-1,c(Cl-)=0.20mol·L-1,则c(SO42-)为 A.0.15mol·L-1 B.0.10mol·L-1 C.0.25mol·L-1 D.0.20mol·L-1 |
|
| 19. 选择题 | 详细信息 |
实验室用有机含碘(主要以I2和IO3-的形式存在)废水制备单质碘的实验流程如下: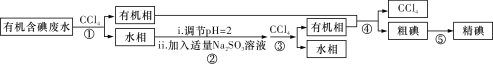 已知:Ⅰ.碘的熔点为113 ℃,但固态的碘可以不经过熔化直接升华; Ⅱ.粗碘中含有少量的Na2SO4杂质。 下列说法正确的是 A. 操作①和③中的有机相从分液漏斗上端倒出 B. 操作②中发生反应的离子方程式为IO3-+3SO32-===I-+3SO42- C. 操作④为过滤 D. 操作⑤可用如图所示的水浴装置进行  |
|
| 20. 选择题 | 详细信息 |
|
下列实验操作中正确的是( ) A.用规格为10 mL的量筒量取6.20 mL的液体 B.蒸发结晶时,可将溶液直接蒸干 C.利用蒸馏或分馏可除去液态混合物中沸点不同的易挥发、难挥发或不挥发的杂质 D.用四氯化碳萃取碘水中的碘,充分静置后紫红色液体在上层 |
|
| 21. 实验题 | 详细信息 |
实验是化学研究的一种重要手段,现有如图所示A~G七种仪器,请根据要求填空。 (1)写出仪器名称:D________,E________。 (2)下列实验操作中用到仪器G的是________(填下列选项的编号字母)。 a.分离水和CCl4的混合物 b.分离水和酒精的混合物 c.分离水和泥沙的混合物 (3)实验室配制100 mL 0.5 mol/L的盐酸。 ①下列关于仪器E的使用方法中,正确的是________(填下列选项的编号字母)。 a.使用前应检查是否漏液 b.使用前必须烘干 c.不能用作物质反应或溶解的容器 d.热溶液可直接转移到其中 ②配制该溶液需用10 mol/L的浓盐酸________mL。取用该体积盐酸时,需要用到上述仪器中的A和________(填仪器的编号字母)。 ③下列操作会使配制的溶液浓度偏高的是________(填下列选项的编号字母)。 a.没有将洗涤液转移到容量瓶中 b.转移过程中有少量溶液溅出 c.摇匀后,液面下降,补充水 d.定容时俯视刻度线 |
|
| 22. 计算题 | 详细信息 |
|
请完成下列填空: (1)当NH3和N2H4所含分子数之比为1∶1时,其所含原子数之比为____,质量之比为____。 (2)现有m g某气体A,其摩尔质量为M g·mol-1。 ①气体A在标准状况下的体积为____L ②A溶于水后形成V L溶液(A与水不反应),所得溶液的物质的量浓度为____ mol·L-1。 (3)将a mL 2 mol·L-1的Mg(NO3)2溶液稀释至b mL,稀释后溶液中NO3-的物质的量浓度为____mol/L (4)一定体积的0.2 mol·L-1的BaCl2溶液,可使相同体积的Na2SO4溶液、KAl(SO4)2溶液、Fe2(SO4)3溶液3种溶液中的SO42-完全沉淀,则上述3种硫酸盐溶液的物质的量浓度比为____。 |
|
| 23. 填空题 | 详细信息 |
|
以下12种物质为中学化学中常见的物质: ①Cu ②NaCl ③NaHSO4 ④SO3 ⑤H2SO4⑥C2H5OH ⑦CaCO3 ⑧BaSO4 ⑨Cu(OH)2⑩Fe(OH)3 请回答下列问题(填序号)。 (1)属于电解质的是_____。 (2)属于非电解质的是_____。 (3)在水溶液中能导电的电解质是_____。 (4)属于弱电解质的是_____。 |
|
| 24. 解答题 | 详细信息 |
|
用一种试剂除去下列各物质中的杂质(括号内为杂质),并写出离子方程式。 (1)BaCl2(HCl):试剂________,离子方程式___________。 (2)CO2(HCl):试剂________,离子方程式__________。 (3) (4)C粉(Fe2O3):试剂____,离子方程式___________。 |
|
| 25. 计算题 | 详细信息 |
|
物质的量在计算中有广泛的应用,请完成下列各小题: (1)标准状况下的甲烷和一氧化碳的混合气体8.96 L,其质量为7.60 g,则混合气体中甲烷的体积为____________;一氧化碳的质量为___________。 (2)固体X在一定条件下加热分解,其化学方程式为2X (3)在同温同压下,6.5 g某气体A的分子数与7 g C2H4的分子数相等,则气体A在标准状况下的密度为________g·L-1(结果保留三位有效数字)。 (4)b%的硫酸与4b%的硫酸等质量混合后,所得溶液的溶质质量分数______(填“>”“<”或“=”,下同)2.5b%;如果等体积混合,所得溶液的溶质质量分数______2.5b%。 |
|
最近更新



