内蒙古包钢第一中学高三化学上册月考试卷试卷完整版
| 1. 选择题 | 详细信息 |
|
下列对古文献记载内容理解错误的是( ) A. 《天工开物》记载:“凡埏泥造瓦,掘地二尺余,择取无沙黏土而为之”。“瓦”,传统无机非金属材料,主要成分为硅酸盐。 B. 《本草纲目》“烧酒”条目下写道:“自元时始创其法,用浓酒和槽入甑,蒸令气上……其清如水,味极浓烈,盖酒露也”。这里所用的“法”是指蒸馏。 C. 《开宝本草》中记载:“此即地霜也,所在山泽,冬月地上有霜,扫取以水淋汁后,乃煎炼而成”。文中对硝酸钾提取涉及到升华操作 D. 《本草经集注》有记载:“以火烧之、紫青烟起,乃真硝石也”,区分硝石(KNO3)和朴硝(Na2SO4),该方法利用了焰色反应 |
|
| 2. 选择题 | 详细信息 |
|
设NA为阿伏加德罗常数的值,下列说法正确的有( )个 ①20℃,101kPa,22.4LCl2通入足量的NaOH溶液充分反应,有NA个电子转移 ②64g灼热的铜丝在硫黄蒸气里完全反应后,失去的电子数为2NA ③标准状况下,NA个NO分子和0.5NA个O2分子充分反应后气体体积为22.4 L ④7.8g Na2S与Na2O2的混合物中阴离子数大于0.1NA ⑤0℃,101kPa,含有lmol硫原子的SO2与SO3的混合物,其体积小于22.4L ⑥常温常压下,17g甲基(-14CH3)所含的中子数为9NA A. 1 B. 2 C. 3 D. 4 |
|
| 3. 选择题 | 详细信息 |
|
常温下,下列各组离子一定能在指定溶液中大量共存的是 A. pH=1的无色溶液中:Na+、Cu2+、Cl-、CH3COO- B. 0.1 mol·L-1 AlCl3溶液中:Cu2+、Mg2+、SO42-、AlO2- C. 由水电离产生的c(H+)=10-12 mol·L-1的溶液中:NH4+、SO42-、HCO3-、Cl- D. 使酚酞变红色的溶液:Na+、Ba2+、NO3-、Cl- |
|
| 4. 选择题 | 详细信息 | ||||||||||||||||||||
下列各组粒子在溶液中可以大量共存,且加入或通入试剂X后,发生反应的离子方程式也正确的是( )
|
|||||||||||||||||||||
| 5. 选择题 | 详细信息 |
|
设NA为阿伏加德罗常数的值。下列说法正确的是( ) A.19gNHD2和19gNH2T中含有的中子数均为10NA B.36g由35Cl和37Cl组成的氯气中所含质子数一定为17NA C.7.8gNa2O2与足量水反应,转移的电子数为0.1NA D.30g由甲醛(HCHO)与乙酸组成的混合物中所含C-H键的数目为2NA |
|
| 6. 选择题 | 详细信息 |
以氯酸钠等为原料制备亚氯酸钠的工艺流程如下,下列说法错误的是 A. NaClO3在发生器中作氧化剂 B. 吸收塔中1mol H2O2得到2mol电子 C. 吸收塔中温度不宜过高,会导致H2O2的分解 D. 从“母液”中可回收的主要物质是Na2SO4 |
|
| 7. 选择题 | 详细信息 |
某学习小组按如图实验过程证明了海带中存在碘元素:下列说法不正确的是( ) A.步骤②中发生反应的离子方程式为2I-+2H++H2O2=I2+2H2O B.步骤③操作后,观察到试管中的溶液变为蓝色,则可说明海带中含有碘元素 C.若步骤②仅滴加稀硫酸后通入氧气,则步骤③操作后,试管中的溶液也变成蓝色 D.步骤①需要将干海带放入蒸发皿中灼烧 |
|
| 8. 选择题 | 详细信息 |
|
现有X、Y、Z、M四种短周期元素,X、Y位于同主族,Z、M位于同主族,Y、Z位于同周期,X与Z、M都不在同一周期,Z的核电荷数是M的2倍。下列说法不正确的是( ) A.简单离子半径由大到小的顺序是:Z>M>Y B.气态氢化物的稳定性:Z<M C.简单阳离子的氧化性:Y>X D.等浓度的X2Z与Y2Z的溶液中,水的电离程度:X2Z<Y2Z |
|
| 9. 选择题 | 详细信息 |
|
下列物质按照混合物、氧化物、弱电解质和非电解质的顺序排列的一组是( ) A.淀粉、CuO、HClO、Cu B.水玻璃、Na2O·CaO·6SiO2、CH3COOH、SO3 C.KAl(SO4)2·12H2O、KClO3、NH3·H2O、CH3CH2OH D.普通玻璃、H2O、Fe(SCN)3、葡萄糖 |
|
| 10. 选择题 | 详细信息 | ||||||||||||||||||||||
下表所列各组物质中,物质之间通过一步反应能实现如图所示转化的是( )
|
|||||||||||||||||||||||
| 11. 选择题 | 详细信息 |
|
下列有关实验装置进行的相应实验,能达到实验目的的是( ) A.用图1所示装置除去CO2中含有的少量HCl  B.用图2所示装置蒸发FeCl3溶液制备无水FeCl3  C.用图3所示装置可以完成“喷泉”实验  D.用图4所示装置制取并收集干燥纯净的NH3  |
|
| 12. 选择题 | 详细信息 |
如图是某化工厂对海水资源综合利用的示意图。根据以上信息,判断下列相关分析不正确的是 A. 上述提取Mg的流程中,没有涉及的反应类型是置换反应 B. 因氮气的化学性质相对稳定,冷却电解无水氯化镁所得的镁蒸气时,可选择氮气 C. 反应⑥所用的气态氧化剂可从本厂生产烧碱处循环利用或从本厂生产镁单质处循环利用 D. 从母液中提取Mg和Br2的先后顺序:先提取Br2,后提取Mg |
|
| 13. 选择题 | 详细信息 |
|
下列有关说法正确的是( ) ①二氧化硅可与NaOH溶液反应,因此可用NaOH溶液雕刻玻璃; ②明矾溶于水可水解生成Al(OH)3胶体,因此可以用明矾对自来水进行杀菌消毒; ③可用蒸馏法、电渗析法、离子交换法等对海水进行淡化; ④只含共价键的纯净物肯定是共价化合物; ⑤干冰升华时范德华力发生了变化,但分子内碳氧双键不变 ⑥H2O分子比H2S分子稳定,因为水分子之间能形成氢键而H2S分子之间不能。 A.③⑤⑥ B.①④⑤ C.①③④⑤⑥ D.③⑤ |
|
| 14. 选择题 | 详细信息 |
向100mL Fe2(SO4)3和CuSO4的混合溶液中逐渐加入铁粉,充分反应后溶液中固体剩余物的质量与加入铁粉的质量如图所示。忽略溶液体积的变化,下列说法正确的是( )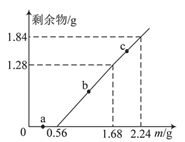 A.a点时溶液中阳离子仅为Cu2+和Fe2+ B.b点时溶液中发生的反应为:Fe+Cu2+=Cu+Fe2+ C.c点时加入的铁粉与Cu2+反应 D.原溶液中Fe2(SO4)3和CuSO4的物质的量浓度之比为1∶1 |
|
| 15. 选择题 | 详细信息 |
由硫铁矿(主要成分:FeS2 和SiO2)为主要原料得到绿矾(FeSO4·7H2O)的流程如下: 下列说法不正确的是( ) A. 过程1,废气中含SO2 B. 过程2,试剂a 为稀硫酸 C. 过程3,离子方程式为2Fe3++SO2+2H2O=2Fe2++SO42-+4H+ D. 过程4,将溶液加热到有较多固体析出,再用余热将液体蒸干,可得纯净绿矾 |
|
| 16. 选择题 | 详细信息 |
|
下列反应的离子方程式正确的是 A. 硫化氢气体通入氯水中:H2S+Cl2=S↓+2Cl-+2H+ B. 向小苏打溶液中加入过量的石灰水:Ca2++2OH-+2HCO3-=CaCO3↓+CO32-+2H2O C. 氟气通入水中: 2F2+2H2O=4F-+4H++O2 D. FeBr2溶液与足量的Cl2反应:2Fe2++2Br-+2Cl2=2Fe3++4Cl-+Br2 |
|
| 17. 选择题 | 详细信息 | |||||||||||||||
下列实验方案、现象、得出的结论均正确的是( )
|
||||||||||||||||
| 18. 选择题 | 详细信息 |
|
类推(类比迁移)的思维方法可以预测许多物质的性质。但类比是相对的,不能违背客观事实。下列类比分析结果正确的是 A. Fe3O4根据化合价规律可表示为FeO•Fe2O3,则Pb3O4也可表示为PbO•Pb2O3 B. CaC2能水解:CaC2 + 2H2O = Ca(OH)2 + C2H2 ↑,则Al4C3也能水解:Al4C3 + 12H2O = 4A1(OH)3↓+ 3CH4↑ C. Cl2与Fe加热生成FeCl3,则I2与Fe加热生成FeI3 D. SO2通入BaCl2溶液不产生沉淀,则SO2通入Ba(NO3)2溶液也不产生沉淀 |
|
| 19. 选择题 | 详细信息 |
某试液中只可能含有K+、NH4+、Fe2+、Al3+、Cl-、SO42-、CO32-、AlO2-中的若干种离子,离子浓度均为0.1mol/L,某同学进行了如下实验: 下列说法正确的是 A. 无法确定原试液中是否含有Al3+、Cl- B. 滤液X中大量存在的阳离子有NH4+、Fe2+和Ba2+ C. 原溶液中存在的离子为NH4+、Fe2+、Cl-、SO42- D. 无法确定沉淀C的成分 |
|
| 20. 选择题 | 详细信息 |
|
高铁酸钾(K2FeO4)是一种既能杀菌、消毒、又能絮凝净水的水处理剂。工业制备高铁酸钾的反应离子方程式为Fe(OH)3+C1O-+OH-→FeO42-+C1-+H2O(未配平)。下列有关说法不正确的是( ) A.上述反应中氧化剂和还原剂的物质的量之比为3:2 B.高铁酸钾中铁显+6价 C.由上述反应可知,Fe(OH)3的氧化性强于FeO42- D.K2FeO4处理水时,不仅能消毒杀菌,而且生成的Fe3+水解形成Fe(OH)3胶体能吸附水中的悬浮杂质 |
|
| 21. 选择题 | 详细信息 |
|
在一定温度下,某浓度的硝酸与金属锌反应生成NO2和NO,两者的物质的量之比为1 : 3,则要使1 mol金属锌完全反应,反应过程中消耗此硝酸的物质的量为 A. 2.4 mol B. 2.6 mol C. 2.8mol D. 3.2 mol |
|
| 22. 选择题 | 详细信息 |
|
反应A+B→C(△H<0)分两步进行①A+B→X(△H>0)②X→C(△H<0)下列示意图中,能正确表示总反应过程中能量变化的是( ) A.  B. B. C.  D. D. |
|
| 23. 选择题 | 详细信息 |
|
已知热化学方程式:2SO2(g)+O2(g) A.相同条件下,2molSO2(g)和1molO2(g)所具有的能量小于2molSO3(g)所具有的能量 B.将2molSO2(g)和1molO2(g)置于一密闭容器中充分反应后,放出热量为QkJ C.对于指定可逆反应的ΔH,表示达到平衡状态时的热量变化 D.如一定量SO2(g)和O2(g)置于某密闭容器中充分反应放热QkJ,则此过程中2molSO2(g)被氧化 |
|
| 24. 选择题 | 详细信息 | ||||||||||||||||||
五种短周期元素的某些性质如表所示(其中只有W、Y、Z为同周期元素)。
|
|||||||||||||||||||
| 25. 选择题 | 详细信息 |
|
已知反应:①25℃、101kPa时,2C(s)+O2(g)=2CO(g) ΔH=‒221kJ·mol-1,②稀溶液中,H+(aq)+OH‒(aq)=H2O(l) ΔH=‒57.3kJ·mol-1。下列说法正确的是( ) A.碳的燃烧热大于110.5kJ·mol-1 B.①的反应热为221kJ·mol-1 C.浓硫酸与稀NaOH溶液反应生成1mol水放出的热量为57.3kJ D.稀醋酸与稀NaOH溶液反应生成1mol水时放出57.3kJ的热量 |
|
| 26. 综合题 | 详细信息 | ||||||||||||
|
|||||||||||||
| 27. 推断题 | 详细信息 |
|
现有A、B、C、D、E、F六种短周期主族元素,原子序数依次增大。已知A的气态氢化物能与其最高价氧化物的水化物反应得到一种离子化合物,B的一种单质具有杀菌消毒的作用,C+和D3+的电子层结构相同,E的主族序数是其周期序数的2倍。 (1)F在元素周期表中的位置是__________________。 (2)上述元素形成的简单离子中,半径最大的是____________(填离子符号)。 (3)由上述元素中的一种或几种组成的物质甲可以发生如下反应:  ①若丙具有漂白性,则甲和水反应的离子方程式为__________________________。 ②若乙的水溶液是强碱性溶液,物质丙为B的一种单质,则甲中含有的化学键的类型为________,D的单质与乙的水溶液反应的离子方程式为_________________。 ③若甲为D和E形成的二元化合物,物质丙是气体,则丙的结构式为___________;物质乙为白色沉淀,其化学式为______________。 |
|
| 28. 综合题 | 详细信息 |
以炼锌烟尘(主要成分为ZnO,含少量CuO和FeO)为原料,制取氯化锌晶体(ZnCl2·xH2O)的工艺流程如图: 已知:Zn及其化合物的性质与Al及其化合物的性质相似,pH>11时,Zn(OH)2能溶于NaOH溶液生成ZnO22-。 (1)碱溶时加入过量NaOH溶液的目的是___,发生反应的化学方程式是___。 (2)沉淀A的主要成分的化学式是___。 (3) “调pH”步骤中通入过量CO2,化学反应方程式___。 (4)酸溶时发生反应的离子方程式是___。 (5)一系列操作过程中的一系列操作是:___、___、过滤、洗涤、干燥。 |
|
| 29. 实验题 | 详细信息 | ||||||||||||||
|
兴趣小组在实验室用制备的氯气与一氧化氮在常温常压下合成亚硝酰氯。 【查阅资料】 亚硝酰氯(NOCl,熔点:-64.5 ℃,沸点:-5.5 ℃) 是一种黄色气体,液体状态呈红褐色,遇水易水解。可用于合成清洁剂、触媒剂及中间体等。对眼睛、皮肤和粘膜有强烈刺激性,具有类似氯气和氮氧化物的毒作用。冰水中加入NaCl可降低温度。 【原料制备】 在实验室分别制备原料气NO和Cl2。 (1)用如下装置制备纯净干燥的气体,请补充下表中各仪器中的试剂。 
|
|||||||||||||||
- 高中化学人教版 选修四 第三章 水溶液中的离子反应 第二节 水的电离和溶液的酸碱性 水的电离和溶液的酸碱性第二课时
- 2016-2017年高一上册化学期中考试考卷带参考答案和解析(山东省淄博市淄川一中)
- 2017-2018年高二上期第二次月考化学在线测验(陕西省西安市长安区第一中学)
- 2017-2018年人教版高二化学 选修五 第二章 烃和卤代烃
- 2016-2017年高一上期化学期中考试考试题(辽宁省大连二十中)
- 2017-2018年高二上学期期中考试化学在线测验(宁夏育才中学)
- 2017-2018年高一12月月考化学在线测验(辽宁省大石桥市第二高级中学)
- 2016-2017年高二上学期期中考试化学考试题(辽宁省抚顺市第十九中学)









