湖北省龙泉中学、潜江中学2020届高三12月联考理综化学免费试卷
| 1. 选择题 | 详细信息 |
|
化学与生活、生产、社会和科技等方面紧密联系,下列说法正确的是 A.向牛奶中加入果汁会产生沉淀,是因为两者间发生了中和反应 B.塑料的老化是因为其主要成分在空气中发生了缓慢的加成反应 C.“雨后彩虹”“海市蜃楼”既是一种绚丽多彩的光学现象,也与胶体的知识有关 D.制作航天服的聚酯纤维和用于光缆通信的光导纤维都是新型无机非金属材料 |
|
| 2. 选择题 | 详细信息 |
有机化合物萜类化合物广泛存在于动植物体内,关于下列萜类化合物的说法正确的是 A.a和b均属于苯的同系物 B.a和b分子中所有碳原子均处于同一平面上 C.a和b均能使酸性KMnO4溶液褪色 D.a物质与足量氢气加成所得产物的一氯代物最多有6种 |
|
| 3. 选择题 | 详细信息 |
下列有关装置对应实验的说法正确的是下列实验中,所选装置或实验设计合理的是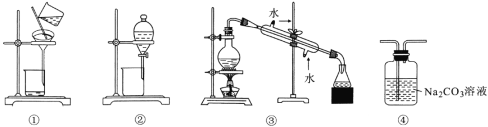 A.用图①所示装置可以除去四氯化碳中混有的溴单质 B.用图②所示装置可以分离乙酸乙酯和饱和碳酸钠的混合溶液 C.用图③所示装置可以分离苯和甲苯的混合溶液 D.用图④所示装置可除去CO2中混有的少量HCl |
|
| 4. 选择题 | 详细信息 |
|
含氮化合物在水体中过多蓄积会导致水体富营养化,需将其从水体中除去,该过程称为脱氮。常用的脱氮方法有吹脱法和折点氯化法。吹脱法:调节水体pH至8左右,然后持续向水中吹入大量空气。折点氯化法:调节水体pH至6左右,向水中加入适量NaClO。下列分析不正确的是 A.含氨和铵盐的水体中存在平衡:NH4++OH-⇋NH3·H2O⇋NH3 + H2O B.吹脱法的原理是通过鼓气降低NH3浓度,从而降低水中NH3·H2O与NH4+的含量 C.折点氯化法除NH4+的原理为:2NH4++3ClO-=N2↑+3Cl-+3H2O+2H+ D.吹脱法无法对含NO2–的水体脱氮,但折点氯化法可以对含NO2–的水体脱氮 |
|
| 5. 选择题 | 详细信息 |
2019年诺贝尔化学奖颁给了三位为锂离子电池发展作出重要贡献的科学家。钴酸锂(LiCoO2)电池的工作原理如图所示,其中A极材料是金属锂和石墨的复合材料(石墨作金属锂的载体),电解质为一种能传导Li+的高分子材料,隔膜只允许特定的离子通过。电池反应式为: LixC6+ Li1-xCoO2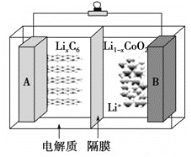 A.充电时Li由B极区域移向A极区域 B.充电时,A为阴极,发生氧化反应C6+xLi++xe-=LixC6 C.放电时,B为正极,电极反应式为Li1-xCoO2+xLi++xe-=LiCoO2 D.废旧钴酸锂(LiCoO2)电池进行“放电处理”使锂进入石墨中而有利于回收 |
|
| 6. 选择题 | 详细信息 |
短周期主族元素W、X、Y、Z的原子序数依次增大,四种元素可以组成一种分子簇,其分子结构如图所示,(球大小表示原子半径的相对大小),W、X位于不同周期,X原子的最外层电子数是次外层电子数的3倍,Z的族序数等于其周期数,下列说法中正确的是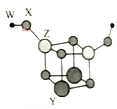 A.Y、Z的简单离子均不影响水的电离平衡 B.工业上获得Y、Z单质均可采用电解它们的熔融氯化物 C.Y的最高价氧化物对应水化物的碱性比Z的弱 D.相同条件下,W单质的沸点比X单质的低 |
|
| 7. 选择题 | 详细信息 |
室温时,配制一组c(H2A)+c(HA-)+c(A2-)=0.10mol·L-1的H2A和NaOH的混合溶液,溶液中部分微粒的物质的量浓度随pH的变化曲线如图所示。下列说法中不正确的是 A.在c(Na+)=0.10mol·L-1的溶液中:c(H2A)-c(OH-)=c(A2-)-c(H+) B.在pH=4 的溶液中, c(HA-)=c(A2-) + c(H2A) C.在pH=7的溶液中:c(Na+)=2c(A2-) D.K1(H2A)的数量级约为10-3.3 |
|
| 8. 综合题 | 详细信息 |
|
焦亚硫酸钠(Na2S2O5)在食品加工中常作防腐剂、漂白剂、疏松剂,焦亚硫酸钠具有还原性,受潮和温度高于150℃易分解,在空气中易被氧化为Na2SO4。 (一)实验室可采用下图1装置制取Na2S2O5。装置Ⅱ中有Na2S2O5晶体析出,发生的反应为:Na2SO3+SO2=Na2S2O5。 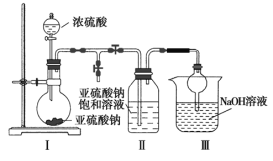 (1)Ⅲ装置中球形干燥管的作用是______________________,要从装置Ⅱ中获得已析出的晶体可采取的分离方法是____________________。 (2)焦亚硫酸钠在空气中久置会被氧化生成连二硫酸钠(Na2S2O6),写出该反应的化学方程式__________________________________________。已知Na2S2O5溶于水即生成NaHSO3。检测Na2S2O5晶体在空气中是否被氧化的实验方案为________________________________。 (二)工业上制取原理是用纯碱与亚硫酸氢钠溶液混合而成的悬浮液吸收二氧化硫至过饱和,再从亚硫酸氢钠过饱和溶液中结晶析出焦亚硫酸钠产品。实验室模拟工业制取焦亚硫酸钠流程如下: 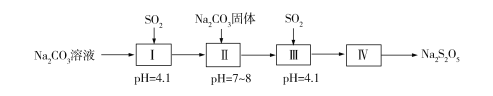 (3)Ⅱ中添加Na2CO3固体目的是________________,Ⅲ中为了减少对环境的污染,需要及时停止通入SO2,此时测量的数据是___________。 (三)测定产品中焦亚硫酸钠的质量分数常用剩余碘量法。 已知:S2O52-+2I2+3H2O=2SO42-+4I-+6H+;2S2O32-+I2 = S4O62-+2I- ①精确称取产品0.20 g放入碘量瓶(带磨口塞的锥形瓶)中。 ②准确移取10.00 mL,1.00 mol/L的标准碘溶液(过量),在暗处放置5min,然后加入5mL冰醋酸及适量的蒸馏水。 ③用标准1.00 mol/L Na2S2O3溶液滴定至接近终点,重复操作3次,平均消耗标准液17.60 mL。 (4)根据上述实验,计算产品纯度为______%(保留一位小数)。若实验过程中滴定终点俯视读数,则测定的结果______(填“偏高”、“偏低”、“无影响”)。 |
|
| 9. | 详细信息 | ||||||||||||||
五氧化二钒(V2O5)是接触法生产硫酸中常用的催化剂。从废钒催化剂中回收V2O5既避免污染环境又有利于资源综合利用。废钒催化剂的主要成分为:
|
|||||||||||||||
| 10. 综合题 | 详细信息 |
|
研究氮氧化物的反应机理,对于消除其对环境的污染有重要意义。请回答下列与氮元素有关的问题: (1)亚硝酸氯(结构式为Cl-N=O)是有机合成中的重要试剂。它可由Cl2和NO在通常条件下反应制得,反应方程式为2NO(g)+Cl2(g)  当Cl2与NO反应生成ClNO的过程中转移了4mol电子,理论上放出的热量为____kJ. (2)在一个恒容密闭容器中充入2molNO(g)和1 mol Cl2(g)发生(1)中反应,在温度分别为T1、T2时测得NO的物质的量(单位:mol)与时间的关系如下表所示 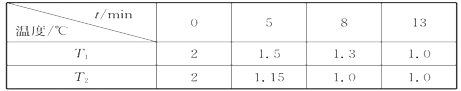 ①T1________T2(填“>“”<”或”=”)。 ②温度为T2℃时,在相同容器中,充入4molNO(g)和2mo1Cl2(g),则NO的平衡转化率___________50%(填“大于”、“等于”或“小于”) ③温度为T2℃时,起始时容器内的强为p0,则该反应的平衡常数Kp=______(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。 (3)近年来,地下水中的氮污染已成为一个世界性的环境问题。在金属Pt、Cu和铱(Ir)的催化作用下,密闭容器中的H2可高效转化酸性溶液中的硝态氮(NO3-),其工作原理如图所示 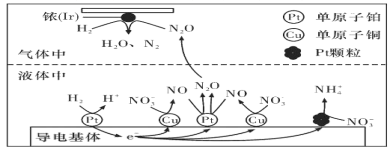 ①Ir表面发生反应的方程式为_________________________________________________。 ②若导电基体上的Pt颗粒增多,造成的后果是___________________________________。 II:利用电化学原理,将NO2、O2和熔融KNO3制成燃料电池,模拟工业电解法来精炼银,装置如图所示 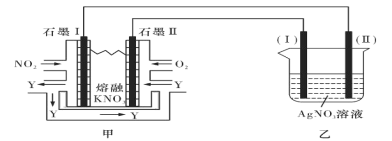 请回答下列问题: (4)①甲池工作时,NO2转变成绿色硝化剂Y,Y是N2O5,可循环使用,则石墨II负极发生的电极反应式为____________________________________________。 ②若用10A的电流电解60min,已知该电解池的电解效率为80.4%,则乙中阴极得到____g质量的Ag。(保留小数点后一位。通过一定电量时阴极上实际沉积的金属质量与通过相同电量时理论上应沉积的金属质量之比叫电解效率。法拉第常数为96500C/mol) |
|
| 11. 综合题 | 详细信息 |
|
在照相底片的定影过程中,未曝光的溴化银(AgBr)常用硫代硫酸钠(Na2S2O3)溶解,反应生成Na3[Ag(S2O3)2];在废定影液中加入Na2S使Na3[Ag(S2O3)2]中的银转化为Ag2S,并使定影液再生。将Ag2S在高温下转化为Ag,就达到了回收银的目的。 (1)铜、银、铬在元素周期表均为过渡金属元素,其中基态铬原子的价电子排布式为______。 (2)Na、O、S简单离子半径由大到小的顺序为___________(用简单离子符号表示离子半径)。 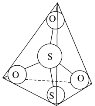 (3)S2O32-离子结构如图1所示,其中心硫原子的杂化轨道类型为________。 (4)Na3[Ag(S2O3)2]中存在的作用力有_____________。 A.离子键 B.共价键 C.范德华力 D.金属键 E.配位键 (5)在空气中灼烧Ag2S生成Ag和SO2,SO2分子空间构型为____________________;与SO3相比,____________的键角更大,原因是________________________________。  (6)如图是金属氢化物储氢材料,其晶胞如图所示,其化学式为____________________,已知该晶体的密度为ρg/cm3,则该晶胞的体积为_________ cm3(用含ρ、NA的代数式表示)。 |
|
| 12. 推断题 | 详细信息 |
某有机物G是一种可用于治疗肿瘤的药物,实验室由芳香烃A制备G的合成路线如下: 回答下列问题: (1)B的结构简式为______________; C的化学名称是______________。 (2)③的反应试剂和反应条件分别是___________________,该反应的类型是__________。 (3)⑤的反应方程式为____________________。 (4)G的分子式为_____________________。 (5)H是G的同分异构体,其苯环上的取代基与G的相同但位置不同,则H可能的结构有__________种。 (6)4-甲氧基乙酰苯胺( |
|
高中化学 试卷推荐
最近更新




