林州市高二化学2019年后半期月考测验同步练习
| 1. 选择题 | 详细信息 |
|
1g碳与适量水蒸气反应生成CO和H2,需吸收10.94KJ热量,此反应的热化学方程式为( ) A. C+H2O==CO+H2ΔH==+131.3KJ·mol—1 B. C(s)+H2O(g)==CO(g)+H2(g)ΔH==+10.94KJ·mol—1 C. C(s)+H2O(l)==CO(g)+H2(g)ΔH==+131.3KJ·mol—1 D. C(s)+H2O(g)==CO(g)+H2(g)ΔH==+131.3KJ·mol—1 |
|
| 2. 选择题 | 详细信息 |
|
强酸与强碱的稀溶液发生中和反应的热效应:H+(aq)+OH-(aq)=H2O(1) ΔH=-57.3kJ/mol。向1L 0.5mol/L的NaOH溶液中加入下列物质:①稀醋酸 ②浓硫酸 ③稀硝酸,恰好完全反应时的热效应ΔH1、ΔH2、ΔH3的关系正确的是( ) A. ΔH1>ΔH2>ΔH3 B. ΔH1<ΔH3<ΔH2 C. ΔH1<ΔH2<ΔH3 D. ΔH1>ΔH3>ΔH2 |
|
| 3. 选择题 | 详细信息 |
|
已知下列热化学方程式: (1)CH3COOH(l)+2O2(g) == 2CO2(g)+2H2O(l) ΔH1=-870.3 kJ·mol-1 (2)C(s)+ O2(g) == CO2(g) △H2=-393.5 kJ•mol-1 (3)H2(g) + 则反应2C(s)+2H2(g) +O2(g) == CH3COOH(l)的△H为( ) A. -488.3 kJ·mol-1 B. -244.15 kJ·mol-1 C. +488.3 kJ·mol-1 D. +244.15 kJ·mol-1 |
|
| 4. 选择题 | 详细信息 |
|
下列热化学方程式中的反应热,表示燃烧热的是( ) A. NH3(g)+ B. C6H12O6(s)+6O2(g) C. C(s) +H2O(g) == CO(g)+H2(g) H=-c kJ·mol-1 D. CH3CH2OH(l)+ |
|
| 5. 选择题 | 详细信息 |
下列装置或操作能达到目的的是( ) A. 装置①依据两容器内气体颜色变化,不能判断反应2NO2(g) B. 装置②依据U管两边液面的高低判断Na和水反应的热效应 C. 装置③测定中和热 D. 装置④依据褪色快慢比较浓度对反应速率的影响 |
|
| 6. 选择题 | 详细信息 |
|
把X气体和Y气体混合于2L容器中使它们发生如下反应,3X(g)+Y(g) A. 1 B. 2 C. 3 D. 4 |
|
| 7. 选择题 | 详细信息 | ||||||||||
|
在一定温度下,将气体X和气体Y各0.16mol充入10L恒容密闭容器中,发生反应X(g)+Y(g) 下列说法正确的是( )
|
|||||||||||
| 8. 选择题 | 详细信息 |
|
在一密闭容器中,反应3A(g)+B(s) A. 增大压强,正、逆反应速率同等程度增大,平衡不移动 B. 升高温度,正反应速率增大,逆反应速率减小,平衡向正方向移动 C. 增加A的浓度,平衡向正方向移动,平衡常数增大 D. 增加B的用量,正、逆反应速率不变,平衡不移动 |
|
| 9. 选择题 | 详细信息 |
如图曲线表示其他条件一定时,2NO(g)+O2(g) A. a点 B. b点 C. c点 D. d点 |
|
| 10. 选择题 | 详细信息 |
在如图所示的三个容积相同的容器①②③中进行如下反应:3A(g)+B(g)  A. ③②① B. ③①② C. ①②③ D. ②①③ |
|
| 11. 选择题 | 详细信息 |
|
已知:4NH3(g) + 5O2(g) =4NO(g) + 6H2O(g),△H= —1025kJ/mol,该反应是一个可逆反应,若反应物起始的物质的量相同,下列关于该反应的示意图不正确的是 A. 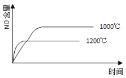 B. 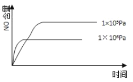 C. 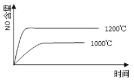 D.  |
|
| 12. 选择题 | 详细信息 |
|
有一支50mL酸式滴定管中盛盐酸,液面恰好在amL刻度处,把管内液体全部放出,盛入量筒内,所得液体体积一定是( ) A. a mL B. (50―a)mL C. 大于(50―a)mL D. 大于amL |
|
| 13. 选择题 | 详细信息 |
|
用水稀释0.1mol/L氨水时,溶液中随着水量的增加而减小的是() A.  ; B. ; B.  ; ;C. c(H+)和c(OH-)的乘积 ; D. OH-的物质的量 |
|
| 14. 选择题 | 详细信息 |
|
下列溶液加热蒸干后,能析出溶质固体的是 A. AlCl3 B. KHCO3 C. Fe2(SO4)3 D. NH4HCO3 |
|
| 15. 选择题 | 详细信息 |
|
1体积pH=2.5的盐酸与10体积某一元强碱溶液恰好完全反应,则该碱溶液的pH等于( ) A. 9.0 B. 9.5 C. 10.5 D. 11.5 |
|
| 16. 选择题 | 详细信息 |
|
25℃时,在某物质的溶液中,由水电离出的c(H+)=1×10-a mol/L,下列说法不正确的是( ) A. a<7时,水的电离受到促进 B. a>7时,水的电离受到抑制 C. a<7时,溶液的pH可能为a D. a>7时,溶液的pH一定为14-a |
|
| 17. 选择题 | 详细信息 |
|
已知当NH4Cl溶液的浓度小于0.1mol/L时,其pH>5.1。现用0.1mol/L的盐酸滴定l0mL0.05mol/L的氨水,用甲基橙作指示剂达到终点时所用盐酸的量应是() A.10mL B.5mL C.大于5mL D.小于5mL |
|
| 18. 选择题 | 详细信息 |
|
某温度下,0.1 mol/L醋酸溶液的pH=3。将该温度下0.2 mol/L醋酸溶液和0.2mol/L醋酸钠溶液等体积混合后,混合液的pH=4.7。下列说法正确的是( ) A. 该温度下,0.0l mol/L醋酸溶液的pH=4 B. 该温度下,用0.1 mol/L醋酸和0.01 mol/L醋酸分别完全中和等体积0.1 mol/L的NaOH溶液,消耗两醋酸的体积比为1∶100 C. 该温度下,0.2 mol/L醋酸溶液和0.4 mol/L醋酸钠溶液等体积混合后,混合液的pH<4.7 D. 该温度下,0.4 mol/L醋酸溶液和0.2 mol/L氢氧化钠溶液等体积混合后,混合液的pH=4.7 |
|
| 19. 填空题 | 详细信息 |
|
基本知识填空 (1)在一定条件下,当一个可逆反应的_____与____相等时,反应物的浓度与生成物的浓度不再改变,即达到化学平衡状态。 (2)化学平衡状态的特征:_____、____、_____、_____、_____。 (3)对于可逆化学反应 mA+nB⇋pC+qD在一定温度下达到化学平衡时,其平衡常数表达式为:______。 (4)强电解质包括的范围:____、____、____。弱电解质包括的范围:____、_____、____、_____。 |
|
| 20. 填空题 | 详细信息 |
|
(1)AgNO3的水溶液呈________________(填“酸”、“中”、“碱”)性,常温时的pH_____7(填“>”、“=”、“<”),原因是(用离子方程式表示):_______________________________________________________________________________________; 实验室在配制AgNO3的溶液时,常将AgNO3固体先溶于较浓的硝酸中,然后再用蒸馏水稀释到所需的浓度,以____________(填“促进”、“抑制”)其水解。 (2)氯化铝水溶液呈_______性 ,原因是(用离子方程式表示):_____________________________________________________________ 。 把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是____________________。 (3)在配制硫化钠溶液时,为了防止发生水解,可以加入少量的______________。 |
|
| 21. 填空题 | 详细信息 |
|
(1)将等体积等物质的量浓度的醋酸和氢氧化钠溶液混合后,溶液呈_______(填“酸性”,“ 中性”或“碱性”,下同),溶液中c(Na+)________c(CH3COO-)(填“>”或“=”或“<”下同)。 (2)pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后溶液呈______,溶液中c (Na+)_________c (CH3COO-)。 (3)物质的量浓度相同的醋酸和氢氧化钠溶液混合后,溶液中醋酸根离子和钠离子浓度相等,则混合后溶液呈__________,醋酸体积___________氢氧化钠溶液体积。 (4)将m mol/L的醋酸和n mol/L的氢氧化钠溶液等体积混合后溶液的pH=7,则醋酸溶液中c(H+)______氢氧化钠溶液中c(OH-),m与n的大小关系是m_________n。 |
|
| 22. 实验题 | 详细信息 |
|
维生素C是一种水溶性维生素(其水溶液呈酸性),它的化学式是C6H8O6,人体缺乏这样的维生素能得坏血症,所以维生素C又称抗坏血酸。在新鲜的水果、蔬菜、乳制品中都富含维生素C,例如新鲜橙汁中维生素C的含量在500mg/L左右。某校课外活动小组测定了某牌子的软包装橙汁中维生素C的含量,下面是测定实验分析报告。(请填写有关空白) (一)测定目的:测定××牌软包装橙汁中维生素C的含量。 (二)测定原理:C6H8O6+I2 →C6H6O6+2H++2I― (三)实验用品及试剂 (1)仪器和用品(自选,略) (2)试剂:指示剂___(填名称),浓度为7.50×10-3mol·L-1的I2标准溶液、蒸馏水等。 (四)实验过程 (1)洗涤仪器,检查滴定管是否漏液,润洗后装好标准碘溶液待用。 (2)用___(填仪器名称)向锥形瓶中移入20.00mL待测橙汁,滴入2滴指示剂。 (3)用左手控制滴定管的___(填部位),右手摇动锥形瓶,眼睛注视___,直到滴定终点。滴定至终点时的现象是___。 (五)数据记录与处理(请在下面设计并画出数据记录和数据处理的表格,不必填数据)。__  若经数据处理,滴定中消耗标准碘溶液的体积是15.00mL,则此橙汁中维生素C的含量是___mg/L。 (六)问题讨论: (1)滴定时能否剧烈摇动锥形瓶?为什么?_____ (2)从分析数据看,此软包装橙汁是否是纯天然橙汁?___(填“是”或“不是”或“可能是”)。制造商最可能采取的做法是____(填编号): A.加水稀释天然橙汁 B.橙汁已被浓缩 C.将维生素C作为添加剂 |
|
| 23. 计算题 | 详细信息 |
|
(1)将pH=l的盐酸平均分成2份,l份加适量水,另1份加入与该盐酸物质的量浓度相同的适量NaOH溶液后,pH都升高了1,则加入的水与NaOH溶液的体积比为_____。 (2)在25℃下,将pH=3的硫酸溶液和pH=10的NaOH溶液混合,若要使混合后溶液的pH=7,则硫酸溶液和NaOH溶液的体积比约为___ (3)在250C时,有pH为a的盐酸和pH为b的NaOH溶液,取Va L该盐酸,同该NaOH溶液中和,需Vb LNaOH溶液。填空: ①若a + b = 14,则Va∶Vb =_____(填数字)。 ②若a + b = 13,则Va∶Vb =_______(填数字)。 ③若a + b >14,则Va∶Vb =______(填表达式)。 |
|
最近更新



