高二后半期期末考试化学试卷在线练习(2019-2020年云南省红河州弥勒市)
| 1. 选择题 | 详细信息 |
|
化学在2020年抗击新型冠状病毒肺炎的战役中发挥了巨大作用。下列说法错误的是 A.防控新冠病毒所用的酒精浓度越大,消毒效果越好 B.防护服、口罩的生产均要用到有机高分子材料 C.过氧化氢、过氧乙酸、84消毒液、二氧化氯泡腾片都可用于环境消毒 D.冷链运输抗病毒疫苗的目的是避免蛋白质变性 |
|
| 2. 选择题 | 详细信息 |
|
化学与生活、环境密切相关,下列说法错误的是( ) A.高纯硅可用于制作光感电池 B.铝合金大量用于高铁建设 C.活性炭具有除异味和杀菌作用 D.碳酸钠可用于去除餐具的油污 |
|
| 3. 选择题 | 详细信息 |
|
下列有关化学用语正确的是 ( ) A.丁烷的球棍模型 C.次氯酸的电子式 |
|
| 4. 选择题 | 详细信息 |
|
“纳米材料”是粒子直径为1~100nm的材料,纳米碳就是其中的一种,若将纳米碳均匀地分散到蒸馏水中,所形成的物质( ) ①是溶液 ②是胶体 ③能产生丁达尔效应 ④能透过滤纸 ⑤不能透过滤纸 ⑥静置后,会析出黑色沉淀 A.①④⑥ B.②③④ C.②③⑤ D.①③④⑥ |
|
| 5. 选择题 | 详细信息 |
|
设NA为阿伏加德罗常数的值,下列说法不正确的是( ) A.0.1mol的11B中,含有0.6NA个中子 B.1L0.2mol/LNaC1O溶液中含有的次氯酸根离子数小于0.2NA C.34gH2O2中含有的化学键数目为3NA D.1molK2Cr2O7被还原为Cr3+转移的电子数为3NA |
|
| 6. 选择题 | 详细信息 |
在生成和纯化乙酸乙酯的实验过程中,下列操作未涉及的是 A. A B. B C. C D. D |
|
| 7. 选择题 | 详细信息 | ||||||||||||||||||||
下列有关实验,对应现象以及结论都正确的是
|
|||||||||||||||||||||
| 8. 选择题 | 详细信息 |
|
X、Y、M、N是短周期主族元素,且原子序数依次增大。已知X原子的最外层电子数是电子层数的3倍,X、M同主族,Y原子在短周期主族元素中原子半径最大。下列说法正确的是 A.Y2X和Y2X2中化学键类型相同,阴、阳离子的个数比相同 B.气态氢化物的热稳定性:M>N C.M与X的化合物对应的水化物一定是强酸. D.离子半径 |
|
| 9. 选择题 | 详细信息 |
|
下列变化中,气体被还原的是 A.氯气使KBr溶液变黄 B.二氧化碳使Na2O2固体变白 C.乙烯使Br2的四氯化碳溶液褪色 D.二氧化硫使KMnO4溶液褪色 |
|
| 10. 选择题 | 详细信息 |
|
下列关于有机物的说法不正确的是( ) A.苯和乙烯均可以使溴水褪色,但褪色原理不同 B.羊毛、蚕丝、塑料、合成橡胶都属于有机高分子材料 C.淀粉、油脂、蛋白质的水解都是由高分子生成小分子的过程 D.分子式为C3H6Cl2的同分异构体共有4种(不考虑立体异构) |
|
| 11. 选择题 | 详细信息 |
|
下列反应的离子方程式不正确的是( ) A.向氯化亚铁溶液中加入稀硝酸:3Fe2++4H++NO B.向碳酸钠溶液中加入少量氢氧化钡固体:CO C.氧化铝与氢氧化钠溶液反应:Al2O3+2OH-=2AlO D.氯气与澄清石灰水反应:Cl2+2OH-=ClO-+Cl-+H2O |
|
| 12. 选择题 | 详细信息 |
|
关于化合物2-苯基丙烯( A.不能使稀高锰酸钾溶液褪色 B.分子中所有原子共平面 C.可以发生加成聚合反应 D.最多能与4mo1Br2发生加成反应 |
|
| 13. 选择题 | 详细信息 |
我国科学家设计二氧化碳熔盐捕获及电化学转化装置,其示意图如下: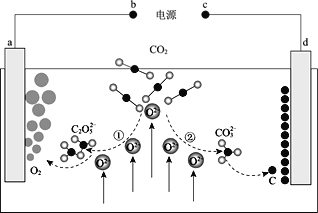 下列说法不正确的是( ) A.b为电源的正极 B.①②中,捕获 CO2 时碳元素的化合价发生了变化 C.a 极的电极反应式为: D.上述装置存在反应:CO2=C + O2 |
|
| 14. 选择题 | 详细信息 |
常温下,用 0.1000 mol·L A.点①所示溶液中: B.点②所示溶液中: C.点③所示溶液中: D.滴定过程中可能出现: |
|
| 15. 实验题 | 详细信息 |
某同学对教材中铜与浓硫酸的实验作出如下改进。实验装置如图所示(加热和夹持装置已略去)。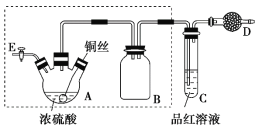 实验步骤: ①组装仪器,检查装置气密性; ②加入试剂,关闭旋塞E,加热A,观察C中溶液颜色变化; ③将铜丝上提离开液面,停止加热。 (1)检查虚线框内装置气密性的方法是____________________________。 (2)装置A的名称是________,装置B的作用是_________,装置D中所盛药品是__________。 (3)装置A中发生反应的化学方程式为____________________________。 (4)实验后,拆除装置前,为避免有害气体的泄漏,应当采取的操作是__________。 (5)实验后装置A中有白色固体产生,将装置A中固液混合物缓慢转移至盛有少量水的烧杯中,可观察到的现象是______________;不可直接向装置A中加水的原因是__________。 |
|
| 16. | 详细信息 |
|
能源和环境保护是世界各国关注的热点话题。请回答下列问题: Ⅰ.研究发现,含pm2.5的雾霾主要成分有SO2、NOx、CxHy及可吸入颗粒等。 (1)雾霾中能形成酸雨的物质是______。 (2)NOx的排放主要来自于汽车尾气,有人利用反应C (s) + 2NO(g)⇌N2(g) +CO2(g) △H=-34.0 kJ·mol-1,用活性炭对NO进行吸附。在恒压密闭容器中加入足量的活性炭和一定量的NO气体,测得NO的转化率α(NO)随温度的变化如图所示:  ①由图可知,1050K 前反应中 NO 的转化率随温度升高而堵大,原因是_____;1100k时,CO2的体积分数为_______。 ②该反应达平衡后,为提高 NO 的转化率, 可采取的措施有________(填字母序号)。 A.增大碳的质量 B.将 CO2 ( g )从体系中分离 C.降低温度 D.改用高效催化剂 Ⅱ.电化学法处理 SO2是目前研究的热点。利用双氧水吸收 SO2,可消除SO2污染, 设计装置如图所示。  (1)石墨1 为____ (填“正极” 或“负极”);正极的电极反应式为____。 (2)H+的迁移方向为_______。 (3)若 11.2 L(标准状况)SO2参与反应,则迁移 H+的物质的量为______。 |
|
| 17. | 详细信息 | |||||||||||||||||||||||||
湿法炼锌产生的铜镉渣主要含锌、镉(Cd)、铜、铁、钴(Co)等金属单质。利用铜镉渣可生产Cu、Cd及ZnSO4·7H2O 等,其生产流程如图: 如表是部分金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为0.1 mol·L-1计算):
|
||||||||||||||||||||||||||
| 18. | 详细信息 |
|
电能是一种无污染、可再生的二级能源。储电材料种类繁多。如图是两种储电材料,请阅读试题、观察图片,回答问题。 Ⅰ.新型碳氮材料的储电能力应用前景广阔。其基本构成单元如图所示。  (1)图1中化学键σ键与π键之比为_____;图2中碳原子的杂化方式为_____。 (2)图3中,储电材料的分子式可以表示为_____。 (3)碳元素与氮元素的电负性大小关系为____。氮元素与氧元素的第一电离能大小关系为_______。 (4)碳的最高价含氧酸根的空间构型是_____;硝酸的酸性强于亚硝酸的原因是_____。 Ⅱ.传统锂电池的主要成分是 LiCoO2 其晶胞结构如图所示;因结构中存在笼状空隙, 可以与Ni 和Mn 发生位置替换, 形成储电性能更加优良的化合物LiNi  (5)基态 Co 原子的价电子排布式为_______; 化合物 LiCoO2 中 O元素在晶胞中的位置,除了位于六棱柱的顶点外,其他具体位置是_____。 (6)已知化合物中各原子半径依次为:Li=a,Ni=b,Mn=c,Co=d,O= e,晶胞的棱长为 m,底边边长为n ,该晶体的空间利用率的计算表达式为________ (用含有 a、b、c、d、e、m、n 的式子表示 )。 |
|
| 19. 综合题 | 详细信息 |
高分子树脂具有较好的吸水性,其合成线路如下: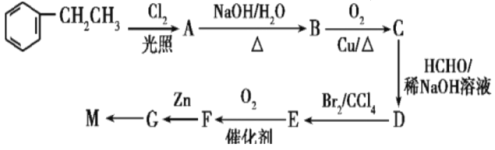 已知:I:-CHO+-CH2CHO II.  -CH=CH-COOH -CH=CH-COOH回答下列问题 (1)G中的含氧官能团名称为______,M的结构简式为_______。 (2)由A生成B的化学方程式为______________________。 (3)上述合成路线中,D→E的转化在合成M中的作用为_________________。 (4)下列选项中对有机物F的性质推测正确的是_______________________。(填字母) A. 1mol F与足量NaHCO3溶液反应放出2molCO2 B. 能发生水解反应和消去反应 C. 能聚合成高分子化合物 D. 1 mol F最多消耗3 mol NaOH (5)符合下列条件的G的同分异构体有________种 A.属于芳香族化合物,且只有1种官能团 B.能发生银镜反应 C.除苯环外不存在其他环状结构 其中核磁共振氢谐有4组峰的是________(写出其中一种的结构简式) (6)根据上述合成路线和信息,以苯乙醛为原料(其他无机试剂任选)设计制备  的合成路线______ 的合成路线______ |
|
- 2016-2017年高一上册化学期中考试考试题(广西南宁八中)
- 2016-2017年高二前半期化学期中考试考题带答案和解析(广东省广州市执信中学)
- 2017-2018年高二12月考化学试卷(辽宁省葫芦岛第六高级中学)
- 2016-2017年高二下学期化学开学考试专题训练(江西省九江市重点高中)
- 2016-2017年高二上学期期中考试化学考试题(浙江省宁波市效实中学)
- 昌吉市高三化学2019年前半期月考测验附答案与解析
- 高中化学人教版 选修四 第三章 水溶液中的离子反应 第三节 盐类的水解 盐类的水解第一课时
- 2016-2017年高二下半年开学考试理综-化学开学考试题开卷有益(福建省厦门第一中学)



