2019-2020年高一上册第一次月考化学在线测验完整版(江苏省苏州市震泽中学)
| 1. 选择题 | 详细信息 |
|
朱自清在《荷塘月色》中写道:“薄薄的青雾浮起在荷塘里…… 月光是隔了树照过来的,高处丛生的灌木,落下参差的斑驳的黑影……”月光穿过薄雾所形成的种种美景的最本质原因是 A. 空气中的小水滴颗粒大小约为10-9 m~10-7 m B. 光是一种胶体 C. 雾是一种胶体 D. 发生丁达尔效应 |
|
| 2. 选择题 | 详细信息 |
|
四种基本类型反应与氧化还原反应的关系可用下列哪个图所示 ( ) A. 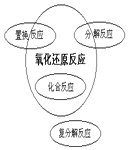 B. B. 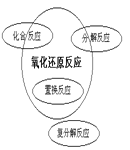 C. 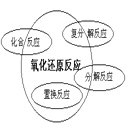 D. D.  |
|
| 3. 选择题 | 详细信息 |
|
下列关于氧化物的叙述正确的是() A. 酸性氧化物均可跟碱反应 B. 酸性氧化物在常温常压下均为气态 C. 金属氧化物都是碱性氧化物 D. 不能跟酸反应的氧化物一定能跟碱反应 |
|
| 4. 选择题 | 详细信息 |
|
清末成书的《化学鉴原》中有一段描述:“各原质(元素)化合所用之数名曰`分剂数'。养气(氧气)以八分为一分剂(即分剂数为八),……一分剂轻气(氢气)为一,……并之即水,一分剂为九”。其中与“分剂数”一词最接近的现代化学概念是 A. 质量分数 B. 物质的量 C. 化合价 D. 摩尔质量 |
|
| 5. 选择题 | 详细信息 |
|
下列说法正确的是 ( ) A.摩尔是国际单位制确定的7个基本物理量之一 B.OH-的摩尔质量为17 C.1 mol O2在常温、常压下的体积大于其在标准状态下的体积 D.气体的摩尔体积约为22.4L/mol |
|
| 6. 选择题 | 详细信息 |
|
设NA表示阿伏加德罗常数的值,下列说法正确的是( ) A.常温常压下,11.2 L氯气所含有的原子数目为NA B.9 g水所含有的氢原子数目为NA C.在同温同压时, 相同物质的量的任何气体的体积相同且为11.2L D.1 mol NH4+ 所含质子数为10NA |
|
| 7. 选择题 | 详细信息 |
|
下列对阿伏加德罗定律及推论的理解不正确的是( ) A.同温同压下,气体的体积之比等于它们的物质的量之比 B.同温同压下,气体的体积之比等于它们的质量之比 C.同温同压下,相同体积的气体质量比等于它们的相对分子质量之比 D.同温同压下,气体的密度之比等于它们的相对分子质量之比 |
|
| 8. 选择题 | 详细信息 |
|
气体体积的大小,跟下列因素几乎无关的是 A. 分子个数 B. 温度 C. 压强 D. 分子直径 |
|
| 9. 选择题 | 详细信息 |
|
下列说法正确的是( ) A.某溶液与NaOH溶液共热,产生使湿润蓝色石蕊试纸变红气体,说明原溶液中存在NH4+ B.某溶液中加入硝酸银溶液时,产生白色沉淀,说明原溶液中含有Cl- C.用铂丝蘸取某溶液在酒精灯上灼烧时,火焰呈黄色,说明原溶液一定是钠盐溶液 D.某溶液中加入BaCl2溶液时,产生白色沉淀,原溶液可能存在Ag+或SO42-或CO32- |
|
| 10. 选择题 | 详细信息 |
|
如果ag某气体中含有的分子数为b,则cg该气体在标准状况下的体积是 A. |
|
| 11. 选择题 | 详细信息 |
|
利用下列实验装置完成相应的实验,能达到实验目的的是( ) A.浓硫酸稀释  B.除去酒精中溶有的少量水 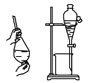 C.实验室中制取少量蒸馏水  D.制备并检验氢气的可燃性  |
|
| 12. 选择题 | 详细信息 |
|
下列说法不正确的是( ) A.液态HCl、固体NaCl均不导电,所以它们均不是电解质 B.NH3、CO2的水溶液均能导电,所以它们均是电解质 C.蔗糖、酒精在水溶液里和熔融状态时均不导电,所以它们是非电解质 D.铜、石墨均导电,但它们不是电解质 |
|
| 13. 选择题 | 详细信息 | ||||||||||||||||||||||||||||||
下列关于物质分类的正确组合是 ( )
|
|||||||||||||||||||||||||||||||
| 14. 选择题 | 详细信息 |
一个密闭容器,中间有一可自由滑动的隔板(厚度不计)将容器分成两部分,当左边充入8molN2,右边充入CO和CO2的混合气体共64g时,隔板处于如图位置(保持温度不变),下列说法正确的是( )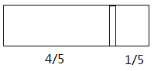 A.右边CO和CO2分子数之比为1:3 B.右边CO的质量为42g C.右边气体密度是相同条件下氧气密度的2倍 D.若改变右边CO和CO2的充入量而使隔板处于距离右端 |
|
| 15. 选择题 | 详细信息 |
|
除去括号内杂质所用试剂和方法不正确的是( ) A. Cu(Fe)----加盐酸,过滤; B. NaCl溶液(碘)----CCl4,萃取、分液; C. KNO3溶液(NaCl)----降温结晶,过滤 D. CO2(HCl)----氢氧化钠溶液,洗气 |
|
| 16. 选择题 | 详细信息 |
|
下列两种气体的分子数一定相等的是( ) A.质量相等、密度不等的N2和C2H4 B.等体积等密度的CO2和N2O C.等压等体积的N2和CO2 D.等温等体积的O2和N2 |
|
| 17. 选择题 | 详细信息 |
|
由Zn、Cu、Al、Fe四种金属中的两种组成的混合物41.5g,与足量的盐酸反应产生的氢气在标况下为22.4升,则混合物中一定含有的金属是 ( ) A.Zn B.Fe C.Al D.Cu |
|
| 18. 填空题 | 详细信息 |
|
有下列物质:①氢氧化钠固体 ②铜丝 ③氯化氢气体 ④稀硫酸⑤二氧化碳气体 ⑥氨水 ⑦碳酸钠粉末 ⑧蔗糖晶体 ⑨熔融氯化钠 ⑩硫酸钡固体,请用序号填空: (1)上述状态下可导电的是______________。 (2)属于电解质的是__________________。 (3)属于非电解质的是__________________________。 |
|
| 19. 填空题 | 详细信息 |
|
选择下列实验方法分离物质,将分离方法的序号填在横线上 A 萃取分液法 B 结晶法 C 分液法 D 蒸馏法 E 过滤法 (1)_____分离饱和食盐水与沙子的混合物。 (2)_____分离水和汽油的混合物。 (3)______分离四氯化碳(沸点为76.75℃)和甲苯(沸点为110.6℃)的混合物。 (4)______从硝酸钾和氯化钠的混合液中获得硝酸钾。 |
|
| 20. 填空题 | 详细信息 |
|
有一固体粉末,,其中可能含有Na2CO3、NaCl、Na2SO4、CuCl2、Ba(NO3)2、K2CO3、K2SO4中的一种或几种,现按下列步骤进行实验。 (1)将该粉末溶于水得无色溶液和白色沉淀。 (2)在滤出的沉淀中加入稀硝酸,有部分沉淀溶解,同时产生无色气体。 (3)取滤液做焰色反应,可证明滤液中含Na+,不含K+。 由上述现象推断:该混合物中一定含有____________;一定不含有____________;可能含有___________,如要检验其是否存在,将如何操作____________。 |
|
| 21. 填空题 | 详细信息 |
|
按要求进行计算,直接写出计算结果: (1) 含0.3 mol Al3+的Al2(SO4)3溶液中所含的SO42-的物质的量是___________。 (2) 10.8g R2O5中氧原子的数目为3.01×1023, 则元素R的相对原子质量为__________; (3) A、B两种金属元素的相对原子质量之比是8:9。将两种金属单质按物质的量之比为3:2组成1.26g混合物。将此混合物与足量稀硫酸溶液反应,放出1.344L(标准状况)氢气。若这两种金属单质在反应中生成氢气的体积相等,则A的相对原子质量是__________ (4) 同温同压下,某容器充满氧气重116g,若充满二氧化碳重122g,现充满某气体重114g,则该气体的摩尔质量为__________ (5)标准状况下,3.4g NH3 的体积为______L ;它与标准状况下_______ L H2S含有相同数目的氢原子。 (6)已知CO、CO2混合气体的质量共11.6g,在标准状况下的体积为6.72L,则混合气体中CO的质量为_______ g;CO2在相同状况下的体积为_______L 。 (7)由CH4和O2的组成的混和气体,在标况下的密度是H2的14.5倍。则该混合气体中CH4和O2的体积比为_______。 (8) Fe、Mg、Al分别与盐酸反应(结果可用分数表示): ①若盐酸足量,等物质的量的Fe、Mg、Al产生H2的质量之比为________。 ②若盐酸足量,等质量的Fe、Mg、Al产生H2的质量之比为________,溶液增重的质量之比为________。 |
|
| 22. 填空题 | 详细信息 |
|
按要求书写在水溶液中的电离方程式: Ba(OH)2:________________________; NaHSO4:____________________________; NaHCO3:________________________; NH4Al(SO4)2:_________________________。 |
|
| 23. 填空题 | 详细信息 |
氯化钾样品中含有少量碳酸钾、硫酸钾和不溶于水的杂质。为了提纯氯化钾,先将样品溶于适量水中,充分搅拌后过滤,再将滤液按如下图所示步骤进行操作(注意事项:①所加试剂必须过量;②过量试剂必须除去;③不能引入新的杂质)。 回答下列问题: (1)试剂Ⅰ的化学式为_______, (2)试剂Ⅱ的化学式为______,②中加入试剂Ⅱ的目的是_____。 (3)试剂Ⅲ的名称是_________,③中发生反应的化学方程式为__________。 |
|
| 24. 计算题 | 详细信息 |
|
取100mL的Na2CO3和Na2SO4混合溶液,加入适量Ba(OH)2溶液100 mL后,恰好完全反应,过滤、干燥后得到14.51g白色沉淀和滤液,再用过量稀硝酸处理沉淀,最后减少到4.66g,并有气体放出。计算: (1)求原混合液中Na2SO4的物质的量?__________________ (2)产生的气体在标准状况下的体积为多少?_________________ |
|
最近更新



