全国2019年高三化学下半年专题练习试卷带解析及答案
| 1. 选择题 | 详细信息 | ||||||||||
下列有关叙述不正确的是
|
|||||||||||
| 2. 选择题 | 详细信息 | |||||||||||||||
下列有关叙述不正确的是
|
||||||||||||||||
| 3. 选择题 | 详细信息 |
|
下列说法正确的是 A.麦芽糖与蔗糖的水解产物均含葡萄糖,故二者均为还原型二糖 B.室温下,将 C.纯碳新材料“碳纳米泡沫”,每个泡沫含有约4000个碳原子,直径约6到9nm,在低于 D.已知 |
|
| 4. 选择题 | 详细信息 | |||||||||||||||
下列实验不能达到预期目的的是
|
||||||||||||||||
| 5. 选择题 | 详细信息 |
|
下列有关说法正确的是 A. 用惰性电极电解1L1mol•L-1的CuSO4溶液,当阴极析出3.2g铜时,加入0.05molCu(OH)2固体可将溶液恢复至原浓度 B. Hg(l)+H2SO4(aq)═HgSO4(aq)+H2(g)常温下不能自发进行,说明△H<0 C. 已知25℃时,Ksp(AgCl)=1.8×10-10、Ksp(Ag2CrO4)=2.0×10-12,所以AgCl的溶解度大于Ag2CrO4的溶解度 D. 25℃时,向0.1 mol•L-1CH3COOH溶液中加入少量CH3COONa固体,该溶液中水的电离程度将增大,且Kw不变 |
|
| 6. 选择题 | 详细信息 |
|
“变化观念与平衡思想”是化学学科的核心素养,室温时0.10mol/L草酸钠溶液中存在多个平衡,其中有关说法正确的是(已知室温时,Ksp(CaC2O4)=2.4×10-9)( ) A.若将溶液不断加水稀释,则水的电离程度增大 B.溶液中各离子浓度大小关系c(Na+)>c(C2O42-)>c(OH-)>c(H+)>c(HC2O4-) C.若用pH计测得溶液的pH=a,则H2C2O4的第二级电离平衡常数Ka2=1013-2a D.向溶液中加入等体积CaCl2溶液,当加入的CaCl2溶液浓度大于2.4×10-8mol/L时即能产生沉淀 |
|
| 7. 选择题 | 详细信息 |
|
中学化学涉及多种常数,下列说法正确的是( ) A.两种物质反应,不管怎样书写化学方程式,平衡常数不变 B.某温度下,2L密闭容器中加入4mol A和2mol B发生反应: 3A(g)+2B(g) C.温度一定时,当溶液中c(Ag+ )· c(Cl-)等于Ksp值时,此溶液为AgCl的饱和溶液 D.难溶电解质AB2饱和溶液中,c(A2+ )=x mol·L﹣1,c(B—)=y mol·L﹣1,则Ksp值为4xy2 |
|
| 8. 选择题 | 详细信息 |
常温下,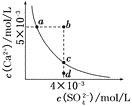 A.在任何溶液中, B.b点将有沉淀生成,平衡后溶液中 C.a点对应的 D.d点溶液通过蒸发可以变到c点 |
|
| 9. 选择题 | 详细信息 |
|
一定温度下,将 A.相同温度下,AgCl的溶解性比 B.沉淀转化反应 C.混合后溶液中的: D.混合后溶液中的: |
|
| 10. 选择题 | 详细信息 |
|
下列说法正确的是 A. |
|
| 11. 选择题 | 详细信息 | ||||||||||||||||||||
下列有关实验操作、现象、解释或结论都正确的是
|
|||||||||||||||||||||
| 12. 选择题 | 详细信息 | ||||||||||||
几难溶物质的有关数值如表所示:下列关于含等物质的量的
|
|||||||||||||
| 13. 选择题 | 详细信息 |
|
设NA为阿伏加德罗常数的值。下列说法错误的是( ) A.100 g溶质质量分数为46%的乙醇水溶液中,含有4NA个氧原子 B.1 mol Cl2溶于水,溶液中Cl-、HClO、ClO-粒子数之和小于2NA C.2.24 L(标准状况)2H2中含有0.2NA个中子 D.25 ℃时Ksp(CaSO4)=9×10-6,则该温度下CaSO4饱和溶液中含有3×10-3NA个Ca2+ |
|
| 14. 选择题 | 详细信息 |
|
pC类似pH,是指稀溶液中溶质物质的量浓度的负对数。如某溶液溶质的浓度为1×10-3mol/L,则该溶液中溶质的pC=3。下列叙述正确的是 A.某温度下,任何电解质的稀溶液中,pC(H+) B.0.01mol/L的CaCl2溶液中逐滴加入纯碱溶液,滴加过程中pC(Ca2+)逐渐增大 C.0.01mol/L的BaCl2溶液中,pC(Cl-) D.用0.01mol/L的盐酸滴定某浓度的NaOH溶液,NaOH溶液的pC(OH-)逐渐减小 |
|
| 15. 选择题 | 详细信息 |
|
25℃时,电离常数Ka(HF)=3.6×10-4mol/L,溶度积Ksp(CaF2)=1.46×10-10,Ksp(AgCl)=4×10-10,Ksp(AgI)=1.0×10-16。下列说法正确的是 ( ) A.AgCl不能转化为AgI B.25℃时,0.1mol/L HF溶液pH=l C.向1L0.1 mol/LHF溶液中加入1L 0.1 mol/LCaCl2溶液,没有沉淀产生 D.25℃时,使AgCl转化为AgI,则加入KI溶液的浓度不低于5×10-12 mol/L |
|
| 16. 选择题 | 详细信息 |
|
已知 A.  B. B. C. 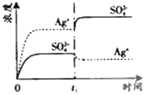 D. D. |
|
| 17. 选择题 | 详细信息 |
|
在 A.FeS的溶解度大于CuS的溶解度 B.饱和CuS溶液中 C.向物质的量浓度相同的 D.向饱和ZnS溶液中加入少量 |
|
| 18. 选择题 | 详细信息 |
|
下列叙述正确的是( ) A. 常温下,10 mL 0.02 mol·L-1 HCl溶液与10 mL 0.02 mol·L-1 Ba(OH)2溶液充分混合,若混合后溶液的体积为20 mL,则溶液的pH=12 B. 在0.1 mol•L﹣1 CH3COONa溶液中:n(OH﹣)+0.1mol>n(CH3COOH)+n(H+)+n(Na+) C. 在10mL 0.1 mol/L的AgNO3溶液中加入6mL等浓度的NaCl溶液,有白色沉淀产生,再加入6 mL等浓度的Na2S溶液,溶液中又有黑色沉淀生成,说明Ksp(Ag2S)< Ksp(AgCl) D. 常温下pH=4的NaHC2O4溶液中:c(H2C2O4)>c(C2O42-) |
|
| 19. 选择题 | 详细信息 |
|
下列有关难溶电解质溶解沉淀平衡的说法不正确的是( ) A.由于Ksp(Ag2S)<Ksp(AgI),向含浓度分别为0.01mol/L的S2-与I-的混合溶液中加入足量的AgNO3(s),只有Ag2S沉淀生成 B.FeS在水中的溶解度大于在Na2S溶液中的 C.向含有AgCl(s)的饱和AgCl溶液中加水,固体AgCl质量会减少,但AgCl的溶解度与Ksp均不变 D.达到沉淀溶解平衡时,溶液中离子浓度不一定相等但会保持不变 |
|
| 20. 综合题 | 详细信息 |
|
对工业废水和生活污水进行处理是防止水体污染的主要措施. |
|
| 21. 综合题 | 详细信息 |
|
氮及其化合物在生产生活中有广泛应用. 反应Ⅰ: 反应Ⅱ: 写出CO将  回答下列问题: |
|
| 22. 综合题 | 详细信息 | ||||||
|
短周期的五种元素A、B、C、D、E,原子序数依次增大。A、B、C三种元素电子层数之和是5。A、B两元素原子最外层电子数之和等于C元素原子最外层电子数;B元素原子最外电子层上的电子数是它的电子层数的2倍,A与D可以形成原子个数比分别为1∶1和2∶1的两种液态化合物;E单质用于净化水质。 请回答: (1)写出D在元素周期表中的位置_____________________, E的原子结构示意图是________。 下列可以验证C与D两元素原子得电子能力强弱的实验事实是____(填写编号)。 A.比较这两种元素的气态氢化物的沸点 B.比较只有这两种元素所形成的化合物中的化合价 C.比较这两种元素的气态氢化物的稳定性 D.比较这两种元素的单质与氢气化合的难易 (2)由A、B两种元素组成的最简单的化合物,写出其电子式____。 (3)均由A、B、C、D四种元素组成的甲、乙两种化合物,都既可以与盐酸反应又可以与NaOH溶液反应,甲为无机盐,其化学式为____,乙为天然高分子化合物的水解产物,且是同类物质中相对分子质量最小的,其结构简式为___________。 (4)胶态磁流体在医学上有重要的用途,而纳米级Fe3O4是磁流体中的重要粒子,其制备过程可简单表示如下: ①将化合物CA3通入等物质的量的FeSO4、Fe2(SO4)3的混合溶液中,生成两种碱,写出该反应过程的总的离子方程式___________________________________。 ②上述反应生成的两种碱继续作用,得到Fe3O4。 (5)已知下表数据:
|
|||||||
| 23. 实验题 | 详细信息 |
|
铁钾矾[KxFey(SO4)m·nH2O]常用作工业媒染剂。其组成可用如下方法测定: ①准确称取2.0120g样品配成100mL溶液A。 ②准确量取25.00mL溶液A,加入盐酸酸化的BaCl2溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体0.466g。 ③准确量取25.00mL溶液A,加入足量的KI溶液,以淀粉为指示剂,用0.1250 mol·L-1的Na2S2O3溶液滴定,消耗8.00mL至终点(已知:I2+2Na2S2O3=2NaI+Na2S4O6)。 (1)要检验出A溶液中存在的Fe3+,可以加入____________溶液。 (2)已知室温下BaSO4的Ksp=1.1×10-10,欲使溶液中c(SO42-)≤1.0×10-5 mol•L-1,应保持溶液中c(Ba2+)≥__________mol·L-1。 (3)步骤③中判断滴定终点的方法是_____________________。 (4)通过计算确定铁钾矾的组成(写出计算过程)________________。 |
|
| 24. 实验题 | 详细信息 |
从废旧锂离子二次电池(主要成分为LiCoO2,还含有少量石墨和镀镍金属钢壳、铝箔以及钙等杂质)中回收钴和锂的工艺流程如下: 回答下列问题: (1)“碱浸”的目的是_______。 (2)“酸浸”过程中LiCoO2发生反应的离子方程式为:___________________________ 浸渣中含有的主要成分是________________。 (3)“萃取净化”除去的杂质离子有Ni2+外,还有_______。 (4)“萃取分离”中钴、锂萃取率与平衡pH关系如图所示, pH一般选择5左右,理由是________。  (5)“沉锂”中Li2CO3溶解度随温度变化曲线如下图所示:  ①根据平衡原理分析Li2CO3在水中溶解度随温度变化的原因_____________________。 ②为获得高纯Li2CO3,提纯操作依次为趁热过滤、________、烘干。 ③若“沉锂”中c(Li+)=1.0 mol·L−1,加入等体积等浓度Na2CO3溶液,此时实验所得沉锂率为________。(已知Li2CO3的Ksp为9.0×10-4) |
|




