2019-2020年高二10月月考化学考试完整版(河北省石家庄市普通高中)
| 1. 选择题 | 详细信息 |
|
下列各组热化学方程式中,△H1>△H2的是 ( ) ①C(s)+O2(g)=CO2(g) △H1 、C(s)+ ②S(s)+O2(g)=SO2(g) △H1 、S(g)+O2(g)=SO2(g) △H2 ③H2(g)+ ④CaCO3(s)=CaO(s)+CO2(g) △H1 、CaO(s)+H2O(l)=Ca(OH)2(s) △H2 A. ① B. ④ C. ②③④ D. ①②③ |
|
| 2. 选择题 | 详细信息 |
|
下列反应中生成物的总能量高于反应物的总能量的是 A. Zn与稀硫酸反应放出氢气 B. 酸碱中和反应. C. 硫在空气中燃烧 D. Ba(OH)2·8H2O与NH4Cl反应 |
|
| 3. 选择题 | 详细信息 |
|
下列热化学方程式书写正确的是(ΔH的绝对值均正确)( ) A.S(s)+O2(g)=SO2(g) ΔH= -296.8 kJ/mol(反应热) B.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) ΔH= +57.3 kJ/mol(中和热) C.C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(g) ΔH= -1 367.0 kJ/mol(燃烧热) D.2NO2=O2+2NO ΔH= +116.2 kJ/mol(反应热) |
|
| 4. 选择题 | 详细信息 |
|
可逆反应A(g)+ 4B(g) A. vA=0.15mol/(L·min) B. vB=0.6 mol/(L·min) C. vC=0.4 mol/(L·min) D. vD=0.01 mol/(L·s) |
|
| 5. 选择题 | 详细信息 |
|
金刚石与石墨是碳的两种同素异形体,在100kPa时,1mol石墨转化为金刚石要吸收1.895kJ的热量,下列说法正确的是( ) ①金刚石比石墨稳定 ②石墨比金刚石稳定 ③1mol石墨比1mol金刚石的总能量高 ④1mol石墨比1mol金刚石的总能量低 A.②③ B.①③ C.②④ D.①④ |
|
| 6. 选择题 | 详细信息 |
|
下列关于热化学方程式的说法中,正确的是( ) A.甲烷的燃烧热ΔH=-890.3kJ/mol,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH =-890.3kJ/mol B.一定条件下,将0.5mol N2和1.5mol H2置于密闭容器中充分反应生成NH3放热19.3kJ,其热化学方程式为:N2(g)+3H2(g) C.在101kPa时,2g H2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)=2H2O(l) ΔH = -571.6kJ/mol D.HCl和NaOH反应的中和热ΔH=-57.3kJ/mol,则H2SO4和Ba(OH)2反应的中和热ΔH=2×(-57.3)kJ/mol |
|
| 7. 选择题 | 详细信息 |
|
有一处于平衡状态的反应A(g) + 3B(g) ①升高温度 ②降低温度 ③ 增大压强 ④降低压强 ⑤加入催化剂 ⑥分离出C A. ①③⑤ B. ②③⑤ C. ②③⑥ D. ②④⑥ |
|
| 8. 选择题 | 详细信息 |
|
已知反应A2+B2=2AB,断开1molA2中的化学键消耗的能量为Q1 kJ,断开1molB2中的化学键消耗的能量为Q2 kJ,生成1molAB中的化学键释放的能量为Q3kJ,则下列说法正确的是 A. 若A2和B2的总能量之和大于生成的2AB的总能量,则反应放热 B. 若A2和B2的总能量之和小于生成的2AB的总能量,则反应放热 C. 若该反应为放热反应,则Q1+Q2<Q3 D. 若该反应为吸热反应,则Q1+Q2<Q3 |
|
| 9. 选择题 | 详细信息 |
|
在一定条件下,反应2HI(g) A. ①③⑥ B. ③⑤⑥ C. ①③⑤ D. ②④⑤ |
|
| 10. 选择题 | 详细信息 |
|
下列平衡体系中,升温或减压都能使平衡向正反应方向移动的是( ) A. N2(g)+3H2(g) B. N2(g)+O2(g) C. C(s)+2H2O(g) D. 2SO2(g)+O2(g) |
|
| 11. 选择题 | 详细信息 |
|
在密闭容器中进行如下反应:X2(g)+Y2(g) A. Z为0.3 mol/L B. Y2为0.4 mol/L C. X2为0.2 mol/L D. Z为0.4 mol/L |
|
| 12. 选择题 | 详细信息 |
|
低温脱硫技术可用于处理废气中的氮氧化物。发生的化学反应为:2NH3(g)+NO(g) A.平衡时,其他条件不变,升高温度平衡向正反应方向移动 B.平衡时,其他条件不变,增加NH3的浓度,废气中氮氧化物的转化率减小 C.单位时间内消耗NO和N2的物质的量比为1:2时,反应达到平衡 D.其他条件不变,使用高效催化剂,废气中氮氧化物的转化率增大 |
|
| 13. 选择题 | 详细信息 |
|
可逆反应:N2(g)+3H2(g) A.v正(N2)=v正(H2) B.v正(N2)=v逆(NH3) C.2 v正(H2)=3v逆(NH3) D.v正(N2)=v逆(H2) |
|
| 14. 选择题 | 详细信息 |
|
一定温度下,在一固定体积的密闭容器中,能说明可逆反应A(s)+3B(g) ①C的生成速率与C的分解速率相等 ②单位时间内生成a mol A,同时生成3a mol B ③气体密度不再变化 ④混合气体的总压强不再变化 ⑤A、B、C的物质的量之比为1:3:2 ⑥混合气体的总物质的量不再改变 A.②④⑤⑥ B.①③④⑥ C.①②④⑥ D.①③④⑤ |
|
| 15. 选择题 | 详细信息 |
|
下列有关叙述错误的是( ) A.化学反应的实质是原子的重新组合 B.表示中和热的热化学方程式:2NaOH(aq)+H2SO4(aq)=Na2SO4(aq)+2H2O(l) ΔH=-57.3kJ/mol C.升高温度,可提高活化分子百分数,使有效碰撞增多,化学反应速率加快 D.已知4P(红磷,s)=P4(白磷,s);ΔH>0,则红磷比白磷稳定 |
|
| 16. 选择题 | 详细信息 |
|
在下面的自发过程中,你认为其中能用熵判据解释的是 A.水由高处流向低处 B.2H2(g)+O2(g)=2H2O(l) ΔH=-483.6 kJ/mol C.墨水滴在水中会扩散到整个水体 D.-10℃的液态水自动结冰成为固态 |
|
| 17. 选择题 | 详细信息 |
|
下列变化不能用勒夏特列原理解释的是( ) A.红棕色的NO2加压后颜色先变深再变浅 B.H2、I2、HI混合气体加压后颜色变深 C.高压比常压有利于合成SO3的反应 D.在夏天喝冰镇碳酸饮料,容易打嗝 |
|
| 18. 选择题 | 详细信息 |
|
对已达到化学平衡的反应2X(g)+Y(g) A.逆反应速率增大,正反应速率减小,平衡向逆反应方向移动 B.逆反应速率减小,正反应速率增大,平衡向正反应方向移动 C.正、逆反应速率都减小,平衡向逆反应方向移动 D.正、逆反应速率都增大,平衡向正反应方向移动 |
|
| 19. 选择题 | 详细信息 |
|
在密闭容器中进行可逆反应,A与B反应生成C,其反应速率分别用vA、vB、vC表示,且vA、vB、vC之间有如下所示关系:vB=3vA、3vC=2vB.则此反应可表示为( ) A.2A+3B=2C B.A+3B=2C C.3A+B=2C D.3A+B=C |
|
| 20. 选择题 | 详细信息 |
右图是恒温下某化学反应的反应速率随反应时间变化的示意图。下列叙述与示意图不相符合的是( )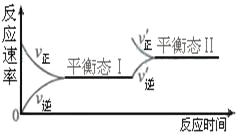 A. 反应达平衡时,正反应速率和逆反应速率相等 B. 该反应达到平衡态Ⅰ后,增大反应物浓度,平衡发生移动,达到平衡态Ⅱ C. 该反应达到平衡态后,减小反应物浓度,平衡发生移动,达到平衡态Ⅱ D. 同一种反应物在平衡态Ⅰ和平衡Ⅱ时浓度不相等 |
|
| 21. 选择题 | 详细信息 |
|
升高温度能加快化学反应速率的主要原因是 A.增加活化分子百分数 B.降低活化分子的能量 C.活化分子能量明显增加 D.降低反应所需的能量 |
|
| 22. 选择题 | 详细信息 |
下图中曲线a表示放热反应X(g)+Y(g)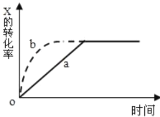 A.升高温度 B.加大 C.使用催化剂 D.缩小体积 |
|
| 23. 选择题 | 详细信息 |
|
对于反应3Fe(s)+4H2O(g) A. K= B. K= C. 增大c(H2O)或减小c(H2),会使该反应平衡常数减小 D. 改变反应的温度,平衡常数不一定变化 |
|
| 24. 选择题 | 详细信息 |
如图是可逆反应2A(g)+2B(g)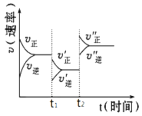 A.t1时,减小了A或B的物质的量浓度 B.t2时,升高了温度 C.t2时,增大了压强 D.t1时,加了催化剂 |
|
| 25. 选择题 | 详细信息 |
|
分析各选项中的各组反应,其中互为可逆反应的是( ) A.2KHCO3 B.CO2+H2O C.NH3+HCl D.2NaCl |
|
| 26. 选择题 | 详细信息 |
|
未来新能源的特点是资源丰富,在使用时对环境无污染或污染很小,且可以再生。下列符合未来新能源标准的是( ) ①天然气 ②煤 ③核能 ④石油 ⑤太阳能 ⑥生物质能 ⑦风能 ⑧氢能 A.①②③④ B.⑤⑥⑦⑧ C.①⑤⑥⑦⑧ D.③④⑤⑥⑦⑧ |
|
| 27. 选择题 | 详细信息 |
|
已知:(1)Zn(s)+1/2O2(g)=ZnO(s);ΔH=-348.3kJ/mol,(2)2Ag(s)+1/2 O2(g)= Ag2O(s);ΔH=-31.0kJ/mol,则Zn(s)+ Ag2O(s)== ZnO(s)+ 2Ag(s)的ΔH等于 ( ) A. -317.3kJ/mol B. -379.3kJ/mol C. -332.8 kJ/mol D. +317.3 kJ/mol |
|
| 28. 选择题 | 详细信息 |
|
1g氢气在氧气中燃烧生成液态水,放出142.9kJ的热量,表示该反应的热化学方程式是( ) A.H2(g)+1/2O2(g) B.H2(g)+1/2O2(g) C.2H2(g)+O2(g) D.H2+1/2O2 |
|
| 29. 选择题 | 详细信息 |
|
实验证明,多数能自发进行的反应都是放热反应。对此说法的理解正确的是 A.所有的放热反应都是自发进行的 B.所有的自发反应都是放热的 C.焓变是影响反应是否具有自发性的一种重要因素 D.焓变是决定反应是否具有自发性的唯一判据 |
|
| 30. 填空题 | 详细信息 | ||||||
|
完成下列填空: (1)下图是N2(g)和H2(g)反应生成1mol NH3(g)过程中能量变化示意图,写出N2和H2反应的热化学方程式:____________________. 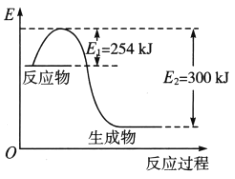 (2)若已知下列数据:试根据表中及图中数据计算N-H的键能____________kJ·mol-1.
|
|||||||
| 31. 填空题 | 详细信息 |
|
在水溶液中橙红色的Cr2O72-与黄色的CrO42-有下列平衡关系:Cr2O72-+H2O (1)向上述溶液中加入NaOH溶液,溶液呈__________色,因为_________。 (2)向已加入NaOH溶液的1中再加入过量稀硫酸,则溶液呈__________色,因为__________。 (3)向原溶液中加入Ba(NO3)2溶液(已知BaCrO4为黄色沉淀)则平衡____________________,溶液颜色将____________________。 |
|
| 32. 填空题 | 详细信息 | ||||||||||||
在一定体积的密闭容器中进行化学反应:CO2(g)+H2(g)
|
|||||||||||||
| 33. 填空题 | 详细信息 |
某温度时,在5L的容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如图所示。请通过计算回答下列问题。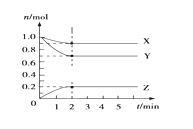 (1)反应开始至2min,Y的平均反应速率____________________ . (2)分析有关数据,写出X、Y、Z的反应方程式____________________. (3)写出提高Y的转化率的两个措施____________________,____________________。 |
|
| 34. 计算题 | 详细信息 |
|
化学反应2SO2(g)+O2(g) |
|
最近更新



