2018-2019年高一下册3月月考试化学免费试卷(山西省晋中市和诚高中有限公司)
| 1. 选择题 | 详细信息 |
短周期主族元素W、X、Y、Z、R的原子序数依次增大,A、B、C、D、E、F均是由上述元素组成的中学化学常见物质,其中A是四元化合物,C是能使湿润红色石蕊试纸变蓝的气体,D具有漂白性,E是单质。各物质之间存在如图转化关系(部分产物未标出)。下列说法不正确的是( ) A. 简单离子半径大小关系:Y>Z>R B. 简单阴离子的还原性:W>Y>Z C. 氢化物的沸点:Z>Y>X D. C和E反应生成F是工业制硝酸的重要反应之一 |
|
| 2. 选择题 | 详细信息 |
|
下列离子方程式正确的是( ) A. 碳酸氢钙溶液与少量氢氧化钠反应:HCO3-+Ca2++2OH− = CaCO3↓+ CO32-+2H2O B. 少量石灰水与过量碳酸氢钠溶液反应:HCO3-+Ca2+ +OH− =CaCO3↓+H2O C. 向溴化亚铁溶液中通入少量氯气:2Fe2++2Br−+Cl2=2Fe3++Br2 +2Cl− D. 向氯化铝溶液中加入过量氢氧化钠溶液:Al3++4OH−=AlO2-+2H2O |
|
| 3. 选择题 | 详细信息 |
|
下列说法正确的是( ) A. 常温常压下,1 mol CH4的体积是22.4 L B. 0.1 mol Fe与Cl2完全反应失去电子数为0.2NA C. 用激光笔照射可鉴别Fe(OH)3胶体和FeCl3溶液 D. SO2能使品红溶液褪色,说明SO2有氧化性 |
|
| 4. 选择题 | 详细信息 |
|
下列有关离子(或物质)的检验及结论中,正确的是( ) A. 向某溶液中滴加NaOH溶液,加热,产生能使湿润的红色石蕊试纸变蓝的气体,说明原溶液中有NH4+ B. 某溶液中加硝酸银溶液生成白色沉淀,说明原溶液中有Cl- C. 取少量试液于试管中,加入稀硝酸酸化的氯化钡溶液,若有白色沉淀生成,说明试液中含有SO42- D. 向某溶液中先滴加几滴氯水,再滴入几滴KSCN溶液后变成红色,说明原溶液中有Fe3+ |
|
| 5. 选择题 | 详细信息 |
|
以下实验操作过程中,溶液里无固体物质析出的是( ) A. 向CuCl2溶液中加入钠的小颗粒 B. 向Fe2(SO4)3溶液中加入少量铜粉 C. 向Mg(NO3)2溶液中加入Na2O2粉末 D. 向Fe(OH)3胶体中逐滴加稀硫酸 |
|
| 6. 选择题 | 详细信息 |
|
铯-139可用于超高精度原子钟,下列对于 A. 核外电子数不同 B. 化学性质相同 C. 质量数不同 D. 互为同位素 |
|
| 7. 选择题 | 详细信息 | ||||||||||||||||||||||||||||||
下列关于纯净物、混合物、强电解质、弱电解质和非电解质的正确组合是( )
|
|||||||||||||||||||||||||||||||
| 8. 选择题 | 详细信息 |
|
2018年是“2025中国制造”启动年,而化学与生活生产社会可持续发展密切相关。下列有关化学知识的说法错误的是( ) A. “玉兔二号”月球车底盘和车轮由SiC颗粒增强铝基复合材料制成,这是由于该复合材料具有重量轻、高刚度、高耐磨、耐冲击的特点 B. 我国发射的“北斗组网卫星”所使用的碳纤维,是一种非金属材料 C. 高纯二氧化硅广泛用于制作光导纤维,光导纤维遇强碱会“断路” D. 钾一钠合金可用于原子反应堆的导热剂,钾与钠都属于短周期主族元素 |
|
| 9. 选择题 | 详细信息 |
|
NA表示阿伏加德罗常数,则下列说法正确的是( ) A. 标况下,22.4L纯净的NO2溶于水转移电子数为2NA/3 B. 2.3g Na(23)常温下在空气中充分反应和在空气中点燃失电子数之比为1:2 C. 7.8gNa2O2(78)与H2O反应转移电子数为0.2NA D. 5.6g Fe(56)与Cl2完全反应,失电子数为2 NA |
|
| 10. 选择题 | 详细信息 |
|
下列除去杂质的实验方法正确的是(括号里为杂质)( ) A. Cl2( HCl):通入饱和NaHCO3溶液 B. K2CO3( NaHCO3):置于坩埚中加热 C. FeCl2( FeCl3):加入足量铜粉,过滤 D. NaCl( I2):加入CCl4后,振荡、静置分液 |
|
| 11. 选择题 | 详细信息 |
|
下列叙述中,不正确的是( ) A. 久置在空气中的NaOH溶液,加盐酸时有气体产生 B. 50 mL 12 mol·L-1的浓盐酸与足量的MnO2反应,生成Cl2的量小于0.15 mol C. 在常温下,浓H2SO4不与Cu反应,是因为铜被钝化 D. 用浓氨水可检验氯气管道是否漏气 |
|
| 12. 选择题 | 详细信息 |
|
短周期元素X、Y、Z、W的原子序数依次增大,X是原子半径最小的元素,Y原子最外层电子数是次外层的3倍;Z与X处于同一主族,W的原子序数是Y的2倍。下列叙述不正确的是( ) A. 原子半径的大小顺序:r(Z)>r(W)>r(Y)>r(X) B. Y的气态氢化物的热稳定性比W的弱 C. X、Y两种元素可形成化合物X2Y、X2Y2 D. Z、W两种元素最高价氧化物对应的水化物之间能发生反应 |
|
| 13. 选择题 | 详细信息 |
|
已知短周期元素的四种离子aA2+、bB+、cC3-、dD-具有相同的电子层结构,则下列叙述中正确的是( ) A. 原子半径:B>A>C>D B. 原子序数:D>C>B>A C. 离子半径:C3->D->A2+>B+ D. 氧化性:A2+>B+,还原性:C3-<D- |
|
| 14. 选择题 | 详细信息 |
|
短周期元素X、Y、Z、W原子序数依次增大。X与W同主族,且X最外层电子数是内层电子数的2倍。Y是ⅤA族元素,Z是地壳中含量最高的金属元素。下列叙述正确的是( ) A. 原子半径:Z > Y > X B. W的氧化物能与某些酸反应 C. 元素Y形成的氧化物只有一种 D. X的简单气态氢化物的热稳定性比W的弱 |
|
| 15. 选择题 | 详细信息 |
|
W、X、Y、Z四种短周期元素在周期表中的相对位置如图所示。W、X、Y、Z原子的最外层电子数之和为21。下列说法中错误的是( ) A. 元素X的单质能与强酸、强碱反应 B. 元素W、X与钠元素可形成化合物Na3XW6 C. 气态氢化物的稳定性:W>Y D. 简单阴离子的还原性:W>Z |
|
| 16. 综合题 | 详细信息 |
|
(1)有以下物质: ①NaHSO4晶体 ②SO3③液态硫酸 ④铁 ⑤BaSO4固体 ⑥饱和FeCl3溶液 ⑦酒精(C2H5OH)⑧熔融的K2SO4,其中能导电的是__________,属于电解质的是__________,属于非电解质的是__________ (2)下列各组化学用语中:①3He、4He ② 2H2 O、1H2O ③ 1H、3H ④14N和13C质子数相同的有_________,中子数相同的有________,互为同位素的有________ (3)化学反应FeS+H2SO4(浓) (4)请写出醋酸(CH3COOH)与氢氧化钠溶液反应的离子方程式_______ (5)盐酸可以除铁锈,请写出发生反应的离子方程式:__________ (6)工业上常用H2O2在酸性条件下氧化污水中的Fe2+,请写出离子方程式:__________ |
|
| 17. 推断题 | 详细信息 |
下表是元素周期表的一部分,表中所列字母分别代表某一元素。根据表中所列元素回答下列问题: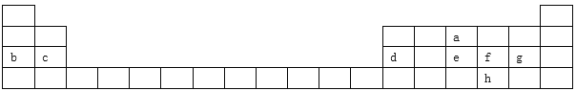 (1)元素d在周期表中的位置是_____________,h与f原子序数相差______________ (2)b、c、f的简单离子半径最小的是___________(填离子符号),原子半径最小的是______(填化学式) (3)表中第三周期元素的非金属性最强是_________(用元素符号表示), e、f、g三种元素的气态氢化物最不稳定的是__________(用化学式表示) (4)g元素与b元素的最高价氧化物对应水化物反应的化学方程式为________________________ 利用元素周期表,我们可以认识更多元素的性质 (5)元素周期表位于对角线的两种元素其性质相似称之为对角线规则。根据周期表对角线规律,金属Be单质及其化合物的性质与铝单质及其化合物的性质相似。则鉴别Be(OH)2和Mg(OH)2可选用的试剂为__________溶液 (6)铅(Pb)、锡(Sn)、锗(Ge)与元素(C)、硅(Si)同主族,常温下其单质在空气中,锡、锗不反应而铅表面生成一层氧化铅;锗与盐酸不反应,而锡与盐酸反应。由此可得出以下结论: ① 锗的原子序数为__________; ② 铅(Pb)、锡(Sn)、锗(Ge)的+4价氢氧化物的碱性由强到弱的顺序为__________(填化学式) (7)最近,德国科学家实现了铷原子气体超流体态与绝缘态的可逆转换,该成果将在量子计算机研究方面带来最重大突破。己知铷(Rb)是37号元素,质量数是85,与钠同主族。回答下列问题: ①铷在周期表中的位置为___________________ ②同主族元素的同类化合物的性质相似,请写出: AlCl3与过量的RbOH反应的离子方程式:_____________________________ ③现有铷和另一种碱金属形成的混合金属50g,当它与足量水反应时,放出标准状况下的氢气22.4L,这种碱金属可能是__________ A.Li(7) B.Na(23) C.K(40) D.Cs(133) |
|
最近更新



