砚山县第二中学高二化学上册期末考试摸底考试题
| 1. 选择题 | 详细信息 |
|
一种新型燃料电池,它以多孔镍板为电极插入KOH溶液中,然后分别向两极上通入乙烷和氧气,其电极反应式为:C2H6+18OH- –14e-→2CO A.通氧气的电极为负极 B.参加反应的氧气与C2H6的物质的量之比为7∶2 C.放电一段时间后,KOH的物质的量浓度不变 D.电解质溶液中,CO |
|
| 2. 选择题 | 详细信息 |
|
在容积为1 L的密闭容器中,加入5 mol A物质,在一定条件下同时发生下列两个反应: (1)2A(g) 当达到平衡时,测得c(A)=2.5 mol·L-1(表示该物质浓度,下同),c(C)=2.0 mol·L-1。则下列说法中正确的是( ) A.达到平衡时A的总转化率为40% B.达到平衡时c(B)为1.0 mol·L-1 C.达到平衡时c(B)=2c(D) D.达到平衡时c(D)=2c(B) |
|
| 3. 选择题 | 详细信息 |
|
下列有关能量转换的说法不正确的是 A. 煤燃烧是化学能转化为热能的过程 B. 化石燃料和植物燃料燃烧时放出的能量均来源于太阳能 C. 动物体内葡萄糖被氧化成CO2是化学能转变成热能的过程 D. 植物通过光合作用将CO2转化为葡萄糖是太阳能转变成热能的过程 |
|
| 4. 选择题 | 详细信息 |
|
下列说法正确的是( ) A.甲酸乙酯和食用植物油均可水解 B.蛋白质、乙酸和糖类均属电解质 C.溴乙烷与NaOH水溶液共热生成乙烯 D.乙醇和乙醛都可以发生加成反应 |
|
| 5. 选择题 | 详细信息 |
|
乙醇、乙二醇(HOCH2CH2OH)、甘油(丙三醇HOCH2CHOHCH2OH)分别与足量金属钠作用,产生等量的氢气,则三种醇的物质的量之比为( ) A.6:3:2 B.1:2:3 C.3:2:1 D.4:3:2 |
|
| 6. 选择题 | 详细信息 |
|
设NA为阿伏加德罗常数的值。下列说法正确的是 A. 1mol·L-1的AlCl3溶液中,含Al3+数小于NA B. 标准状况下,将2.24L 氯化氢溶于足量水中,溶液中含有的HCl分子数为NA C. 1mol NaBH4中含的离子的数目为6NA D. 30g甲醛(HCHO)和醋酸的混合物中含碳原子数目为NA |
|
| 7. 选择题 | 详细信息 |
|
下列关于中和热的说法不正确的是( ) A.发生酸碱中和反应时所放出的热量叫中和热 B.中和反应的实质是H+与OH-结合生成水,若有其他物质生成,这部分反应热不在中和热内 C.在稀溶液中,酸跟碱发生中和反应生成1mol水时所放出的热量称为中和热 D.中和热不包括物质溶解、电离、水合等过程中的热效应 |
|
| 8. 选择题 | 详细信息 |
|
有机物分子中的原子(团)之间会相互影响,导致相同的原子(团)表现不同的性质。下列各项事实不能说明上述观点的是( ) A.甲苯能使高锰酸钾酸性溶液褪色,而甲基环己烷不能使高锰酸钾酸性溶液褪色 B.乙烯能与溴水发生加成反应,而乙烷不能发生加成反应 C.苯酚可以与NaOH反应,而乙醇不能与NaOH反应 D.苯酚与溴水可直接反应,而苯与液溴反应则需要FeBr3作催化剂 |
|
| 9. 选择题 | 详细信息 |
下表是五种银盐的溶度积常数(25℃): 下列说法错误的是( ) A.五种物质在常温下溶解度最大的是Ag2SO4 B.将氯化银溶解于水后,向其中加入Na2S,则可以生成黑色沉淀 C.氯化银、溴化银和碘化银三种物质在常温下的溶解度随着氯、溴、碘的顺序增大 D.沉淀溶解平衡的建立是有条件的,外界条件改变时,平衡也会发生移动 |
|
| 10. 选择题 | 详细信息 |
合成氨反应的正反应是气体体积减小的放热反应。合成氨工业的生产流程如下: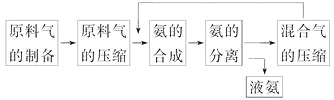 关于合成氨工业的说法中不正确的是( ) A.混合气进行循环利用遵循绿色化学思想 B.合成氨反应须在低温下进行 C.对原料气进行压缩是为了增大原料气的转化率 D.使用催化剂可以提高反应的速率,但是不能使平衡向正反应方向移动 |
|
| 11. 选择题 | 详细信息 |
|
下列哪组离子能在水溶液中大量共存( ) A.K+、NO3-、Al3+、AlO2- B.Na+、SO42-、K+、Cl- C.SO42-、Ag+、Cl-、K+ D.Fe2+、Cl-、H+、NO3- |
|
| 12. 选择题 | 详细信息 |
|
在一密闭容器中,反应mA(g)+nB(g) A.A的质量分数增加 B.平衡不移动 C.化学计量数:m+n=3 D.物质C的体积分数增大 |
|
| 13. 选择题 | 详细信息 |
|
某浓度的氨水中存在下列平衡:NH3·H2O A.通入HCl B.加入NH4Cl固体 C.加入少量FeCl3 D.加入少量NaOH |
|
| 14. 选择题 | 详细信息 |
|
大雁体内的主要能源物质和储能物质分别是( ) A.糖类和脂肪 B.脂肪和蛋白质 C.脂肪和糖元 D.脂肪和脂肪 |
|
| 15. 选择题 | 详细信息 |
|
下列反应的产物中,有的有同分异构体,有的没有同分异构体,其中一定不存在同分异构体的反应是 A.异戊二烯( B.2氯丁烷与NaOH乙醇溶液共热发生消去HCl分子的反应 C.甲苯在一定条件下发生硝化反应生成一硝基甲苯的反应 D.邻羟基苯甲酸与NaHCO3溶液反应 |
|
| 16. 选择题 | 详细信息 |
|
下列说法中正确的是( ) A.乙醇、乙二醇、丙三醇互为同系物,同系物之间不可能为同分异构体 B.二氧化碳和干冰互为同素异形体 C.C2H5OH和CH3OCH3互为同分异构体 D.金刚石和石墨互为同位素 |
|
| 17. 选择题 | 详细信息 |
|
物质的量浓度相同的下列溶液中,含微粒种类最多的是( ) A.CaCl2 B.CH3COONa C.NH4Cl D.Na2S |
|
| 18. 选择题 | 详细信息 |
|
在中和滴定实验中用到的仪器,只需用蒸馏水洗净不能用待盛放液体润洗的是( ) A.酸式滴定管 B.碱式滴定管 C.移液管 D.锥形瓶 |
|
| 19. 选择题 | 详细信息 |
|
纯水在25℃和80℃时氢离子浓度的大小关系是 A.前者大 B.相等 C.前者小 D.不能确定 |
|
| 20. 选择题 | 详细信息 |
|
为了防止钢铁锈蚀,下列防护方法中正确的是( ) A.在精密机床的铁床上安装铜螺钉 B.在排放海水的钢铁阀门上用导线连接一块石墨,一同浸入海水中 C.在海轮舷上用铁丝系住锌板浸在海水里 D.在地下输油的铸铁管上接直流电源的正极 |
|
| 21. 选择题 | 详细信息 |
|
决定化学反应速率的内因是( ) ①温度 ②压强 ③催化剂 ④浓度 ⑤反应物本身的性质 A. ①②③④⑤ B. ⑤ C. ①④ D. ①②③④ |
|
| 22. 选择题 | 详细信息 |
|
下列叙述正确的是 A.所有卤代烃都难溶于水,且都是密度比水大的液体 B.所有卤代烃都是通过取代反应制得 C.卤代烃不属于烃类 D.卤代烃都可发生消去反应 |
|
| 23. 选择题 | 详细信息 |
|
将1 mol X、3 mol Y充入一个密闭容器中,在一定条件下发生如下反应并达到平衡:X(g) +3Y(g) A.升高温度,X的体积分数减小 B.缩小体积,Y的物质的量浓度不变 C.保持容器体积不变,充入1mol的稀有气体He,Z的浓度不变 D.保持容器体积不变,充入2mol的Z(g),X的体积分数增大 |
|
| 24. 填空题 | 详细信息 |
如图所示,某同学设计一个甲醚(CH3OCH3)燃料电池并探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜。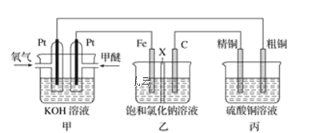 (1)通入氧气的电极为________极,写出负极电极反应式____________________。 (2)铁电极为________极,石墨电极(C)的电极反应式为____________________。 (3)反应一段时间后,乙装置中生成NaOH主要在_____极区(填电极材料)。 (4)如果粗铜中含有锌、银等杂质,丙装置中阳极上电极反应式为___________、___________。反应一段时间,硫酸铜溶液浓度将________(填“增大”、“减小”或“不变”)。 |
|
| 25. 填空题 | 详细信息 |
|
金属材料、无机非金属材料、有机高分子材料是人类使用的三大类基础材料,它们以各自的特点满足着人类多方面的需要。 (1)金属材料中,有一类贮氢合金能够结合氢气形成金属化合物,并在一定条件下分解释放出氢气,该贮运原理属于_______变化,钢铁是制造轮船的主要金属材料,船身外通常装上一定数目比铁更活泼的金属块以防止腐蚀,该金属块可以选择_______(选填“铜块”、“锌块”、“铅块”); (2)无机非金属材料中,用于电子工业的高纯碳酸钙、高纯氧化钙生产流程如下: 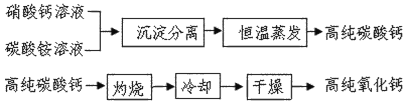 请回答下列问题: ①硝酸钙与碳酸铵在溶液中反应,其基本反应类型为_______; ②实验室常采用_______操作进行沉淀分离; ③生产高纯碳酸钙时,选择“220℃恒温干燥”而不选择“灼烧”的原因是_______; ④高纯氧化钙生产过程中,“干燥”的主要目的是为了防止______(用化学方程式表示); (3)有机高分子材料“玉米塑料”,因其可降解被广泛用来替代一次性泡沫塑料,“玉米塑料”的使用可减少_______污染,20世纪30年代,尼龙因其抽成细丝极像蚕丝而被推向世界,生活中可采用______方法区分尼龙和蚕丝。 |
|
| 26. 实验题 | 详细信息 |
实验室可利用甲醇、空气和铜制备甲醛。甲醇和甲醛的沸点和水溶性见下表: 如图是两个学生设计的实验装置,右边的反应装置相同,而左边的气体发生装置不同,分别如(甲)和(乙)所示,试回答:  (1)若按(甲)装置进行实验,则通入A管的X是____,B中反应的化学方程式为____。 (2)若按(乙)装置进行实验,则B管中应装____,反应的化学方程式为____。 (3)C中应装的试剂是____。 (4)在仪器组装完成后,加试剂前都必须要进行的操作是____;添加药品后,如何检验(乙)装置的气密性?____。 (5)两种装置中都需加热的仪器是____(填“A”、“B”或“C”),加热的方式分别为____。实验完成时,都应先停止对_____(填“A”、“B”或“C”)的加热,再_____。实验完成时,先打开D处气球的铁夹,再撤去酒精灯,打开铁夹的目的是_____,其工作原理为_____。 (6)你认为哪套装置好?____(填“甲”或“乙”),理由是____。 |
|
| 27. 综合题 | 详细信息 |
|
已知2A2(g)+B2(g) (1)a________b(填“>”“=”或“<”)。 (2)若将反应温度升高到700 ℃,该反应的平衡常数将________(填“增大”“减小”或“不变”)。 (3)若在原来的容器中,只加入2 mol C,500 ℃时充分反应达到平衡后,吸收热量ckJ,C的浓度________wmol/L(填“>”“=”或“<”),a,b,c之间满足何种关系:________(用等式表示)。 (4)能说明该反应已经达到平衡状态的是________。 a.v(C)=2v(B2) b.容器内压强保持不变 c.v逆(A2)=2v正(B2) d.容器内的密度保持不变 (5)使该反应的反应速率增大,且平衡向正反应方向移动的操作是________。 a.及时分离出C气体 b.适当升高温度 c.增大B2的浓度 d.选择高效的催化剂 (6)若将上述容器改为恒压容器(反应前后气体压强相同),起始时加入2 mol A2和1 mol B2,500 ℃时充分反应达到平衡后,放出热量dkJ,则d________b(填“>”“=”或“<”),理由是_________。 |
|
| 28. 推断题 | 详细信息 |
阿司匹林(化学名称为乙酰水杨酸)是具有解毒、镇痛等功效的家庭常备药,科学家用它连接在高分子载体上制成缓释长效阿司匹林,其部分合成过程如下: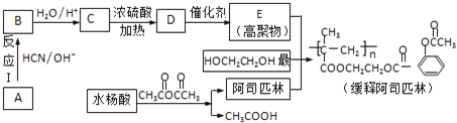 已知:醛或酮均可发生下列反应:CH3CHO (1)水杨酸的化学名称为邻羟基苯甲酸,则水杨酸的结构简式为__; (2)反应Ⅰ的反应类型是__反应.HOCH2CH2OH可由1,2﹣二溴乙烷制备,实现该制备所需的反应试剂是__; (3)写出C→D的反应方程式______; (4)C可发生缩聚反应生成高聚物,该高聚物的结构简式为____; (5)阿司匹林与甲醇酯化的产物在氢氧化钠溶液中充分反应的化学方程式为______; (6)下列说法正确的是__; a.服用阿司匹林出现水杨酸中毒,应立即停药,并静脉注射NaHCO3溶液 b.1mol HOCH2CH2OH的催化氧化产物与银氨溶液反应,理论上最多生成2mol银 c.A的核磁共振氢谱只有一组峰 d.两分子C发生酯化反应可生成8元环状酯 (7)写出缓释阿司匹林在体内水解生成阿司匹林、高聚物E等物质的反应方程式__; (8)水杨酸有多种同分异构体,其中属于酚类且能发生银镜反应的同分异构体有__种。 |
|
高中化学 试卷推荐
最近更新



