2017-2018年高一前半期第二次月考化学在线测验(陕西省西安市长安区第一中学)
| 1. | 详细信息 |
|
下列物质是属于非电解质的是 ( ) A. NH3 B. (NH4)2SO4 C. Cl2 D. CH3COOH |
|
| 2. | 详细信息 |
|
某种具有净水作用的无机高分子混凝剂的化学式可以表示为? [Al2(OH)nClm?yH2O]x ,式中的m等于( ) A. 3-n B. 6-n C. n+6 D. n+3 |
|
| 3. | 详细信息 |
|
要验证Mg、Fe、Cu三种金属的活动性顺序,可选用下列哪组物质进行实验( ? ) A. Fe、CuSO4溶液、MgCl2溶液 B. Fe、Cu、MgCl2溶液 C. Mg、CuO、FeSO4溶液 D. Cu、FeCl2溶液、MgCl2 溶液 |
|
| 4. | 详细信息 |
|
下列物质存放方法错误的是( ) A. 铝片长期放置在不密封的纸盒里 B. 过氧化钠长期放置在烧杯中 C. FeSO4溶液存放在加有少量铁粉的试剂瓶中 D. 金属钠存放于煤油中 |
|
| 5. | 详细信息 |
|
在无色强酸性溶液中,下列各组离子能够大量共存的是 ( ) A. Cl -、Na+、NO3-、Ca2+ B. NH4+、HCO3-、Cl-、K+ C. K+、Ba2+、Cl-、SO42- D. Cu2+、NH4+、I-、Cl- |
|
| 6. | 详细信息 |
|
下列反应既是氧化还原反应又是离子反应的是( ) A. 用CO还原氧化铁来炼铁 B. 用稀硫酸除铁锈 C. 用锌和稀盐酸反应制氢气 D. CO2通入澄清石灰水变浑浊 |
|
| 7. | 详细信息 |
|
在溶液中加入足量Na2O2后仍能大量共存的离子组是( ) A. NH4+、Ba2+、Cl-、NO3- B. K+、ClO-、Cl-、SO42- C. Ca2+、Mg2+、NO3-、HCO3- D. Na+、Cl-、CO32-、SO32- |
|
| 8. | 详细信息 |
|
在甲、乙、丙、丁四个烧杯里分别放入0.1mol的钠,氧化钠,过氧化钠和氢氧化钠,然后各加入100mL水,使固体完全溶解,则甲、乙、丙、丁的溶液中溶质的质量分数大小的顺序为 A.甲>乙>丙>丁 B.丁<甲<乙=丙 C.甲=丁<乙=丙 D.丁<甲<乙<丙 |
|
| 9. | 详细信息 |
|
下列实验操作正确或能达到目的的是( ) A. 托盘上各放一张滤纸,然后在右盘上添加2g砝码,称取2.0gNaOH固体 B. 因为碘易溶于CCl4,所以常用CCl4萃取碘水中的碘 C. 向沸水中边滴加FeCl3溶液边用玻璃棒搅拌,可制得Fe(OH)3胶体 D. 检验红砖中的红色物质是否是Fe2O3的操作步骤为:样品→粉碎→加水溶解→过滤→向滤液中滴加KSCN溶液。 |
|
| 10. | 详细信息 |
|
在酸性条件下,可发生如下反应:ClO3-+2M3++4H2O=M2O7n-+Cl-+8H+,M2O7n-中M的化合价是( ) A. +4 B. +5 C. +6 D. +7 |
|
| 11. | 详细信息 |
|
用NA表示阿伏加德罗常数的值,下列说法中正确的是( ) A. 5.6 g铁与足量盐酸反应转移的电子数为0.3NA B. 18gNH4+所含电子数为11NA C. 标准状况下,22.4 L氦气与22.4 L氟气所含原子数均为2NA D. 常温下,2.7g铝与足量的盐酸反应,失去的电子数为0.3NA |
|
| 12. | 详细信息 |
向100 mL NaOH溶液中通入一定量的CO2气体,充分反应后,再向所得溶液中逐滴加入0.2 mol?L-1的盐酸,产生CO2的体积与所加盐酸体积之间关系如图所示。下列判断正确的是( ) A. 原NaOH溶液的浓度为0.2 mol?L-1 B. 通入CO2在标准状况下的体积为448 mL C. 所得溶液的溶质成分的物质的量之比为n(NaOH)∶n(Na2CO3)=1∶3 D. 所得溶液的溶质成分的物质的量之比为n(NaHCO3)∶n(Na2CO3)=1∶1 |
|
| 13. | 详细信息 |
|
关于化学反应 Al2O3+N2+3C = 2AlN+3CO 叙述正确的是( ? ) A. 上述反应中,每生成1 mol AlN需转移3 mol电子 B. 上述反应中,N2是还原剂,Al2O3是氧化剂 C. AlN中氮元素的化合价为+3价 D. AlN的摩尔质量为41 g |
|
| 14. | 详细信息 | |||||||||||||||||||||
Na、Al、Fe、Cu是中学化学中重要的金属元素。它们的单质及其化合物之间有很多转化关系。下表所列物质不能按如图(“→”表示一步完成)关系相互转化的是( )
|
||||||||||||||||||||||
| 15. | 详细信息 |
|
在MgCl2、KCl、K2SO4三种盐的混合溶液中,若K+、Cl-各为1.5 mol/L,Mg2+为0.5 mol/L,则SO42-的物质的量浓度为 A. 0.1 mol/L B. 0.5 mol/L C. 0.15 mol/L D. 0.25 mol/L |
|
| 16. | 详细信息 |
|
某溶液只可能含有K+、Al3+、Fe3+、Mg2+、Ba2+、NH ①第一份加过量的氢氧化钠溶液后加热,收集到0.02 mol的气体,无沉淀产生,同时得到溶液甲。 ②向溶液甲中通入过量的二氧化碳气体,生成白色沉淀,沉淀经过滤,洗涤灼烧后,得到1.02 g固体。 ③第二份加足量的氯化钡溶液,生成白色沉淀,沉淀经盐酸充分洗涤,干燥,得到11.65 g固体。据此,该同学得到的结论正确的是( ) A. 实验①中产生的气体为氨气,并可得原溶液中c(NH B. 实验③中的白色沉淀中一定是BaSO4,并可得原溶液中n(SO C. 原溶液中一定有K+,且c(K+) ≥0.4 mol?L-1 D. 若要判断原溶液中是否有Cl-,无需另外设计实验验证 |
|
| 17. | 详细信息 |
现有AlCl3和MgSO4混合溶液,向其中不断加入NaOH溶液,得到沉淀的量与加入NaOH溶液的体积如图所示,原溶液中Cl-与SO42-的物质的量之比为( ) A. 1 :3 B. 2 :3 C. 6 :1 D. 3 :1 |
|
| 18. | 详细信息 |
|
下列离子方程式的书写正确的是 ( ) A. 实验室用大理石和稀盐酸制取CO2:2H+ + CO32- = CO2↑+ H2O B. 钠和冷水反应:Na+2H2O=Na++2OH?+H2↑ C. 向AlCl3溶液中加入过量的NaOH溶液:Al3+ + 3OH- = Al(OH)3↓ D. NaHCO3溶液与NaOH溶液反应: OH- + HCO3- = CO32- + H2O |
|
| 19. | 详细信息 |
|
向含有Mn2+的酸性溶液中滴加过二硫酸钾(K2S2O8)溶液,发生如下反应(未配平,不考虑滴加后溶液体积变化):Mn2++S2O82?+H2O→MnO4?+SO42?+H+,下列说法正确的是( ) A. 反应后溶液的酸性减弱 B. 该反应中起氧化作用的是Mn2+ C. 有1mol还原剂参加反应时,转移5mol电子 D. 用过二硫酸钾(K2S2O8)溶液检验Mn2+存在的实验现象是溶液紫红色消失 |
|
| 20. | 详细信息 |
|
某金属M的硝酸盐受热时按下列方式发生分解反应:2MNO3 A. 23 B. 40 C. 108 D. 201 |
|
| 21. | 详细信息 |
化学兴趣小组的同学为测定某Na2CO3和NaCl的固体混合物样品中Na2CO3的质量分数进行了以下实验。请你参与并完成对有关问题的解答: (1)甲同学用图1所示装置测定CO2的质量。实验时稀硫酸是与样品中的__________(填“Na2CO3”或“NaCl”)发生反应,仪器b的名称是__________,洗气瓶c中盛装的是浓硫酸,此浓硫酸的作用是____________________。 (2)乙同学用图2所示装置,取一定质量的样品m g和足量稀硫酸反应进行实验,完成样品中Na2CO3质量分数的测定。 ①实验前,检查该装置气密性的方法是先打开活塞a,由b注入水至其下端玻璃管中形成一段水柱,再将针筒活塞向内推压,若b下端玻璃管中的___________________,则装置气密性良好。 ②在实验完成时,能直接测得的数据是CO2的______(填“体积”或“质量”)。 (3)丙同学用下图所示方法和步骤进行实验: 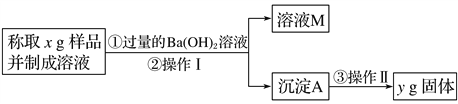 ①操作Ⅰ涉及的实验名称有:__________、洗涤;操作Ⅱ涉及的实验名称有干燥、__________。 ②丙同学测得样品中Na2CO3的质量分数为__________。 |
|
| 22. | 详细信息 |
|
(1)在标准状况下,CO和CO2混合气体的质量为3.2g,体积为2.24L,则其中CO与CO2质量之比为_______,若阿伏加德罗常数为NA,则所含O原子的数目为______。 (2)在________mL 0.2 mol/L NaOH溶液中含1 g溶质;配制480 mL 0.2 mol/L CuSO4溶液,需要称量CuSO4?5H2O _________g。 (3)取100 mLNa2CO3和Na2SO4的混合溶液,加入过量BaCl2溶液后得到29.02 g白色沉淀,用过量稀盐酸处理后沉淀量减少到9.32 g,并有气体放出。原混合溶液中Na2SO4的物质的量浓度为________mol?L-1;产生的气体在标准状况下的体积为________L。 (4)在实验室将16.8g固体NaHCO3加热一段时间后,测得剩余固体的质量变为13.7g.则有______ g NaHCO3固体发生了分解反应。若继续对剩余固体加热,至不再产生气体后,将冷却后的固体溶解于水,配成1000mL的溶液.则该溶液溶质的物质的量浓度是____________。 (5)向1L AlCl3和FeCl3混合溶液中加入含a mol NaOH的溶液时,产生的沉淀量可达最大值,继续加入NaOH溶液,沉淀开始溶解,当前后加入的NaOH总量达到b mol时,沉淀不再减少,则原溶液中Fe3+的物质的量浓度为_________。 |
|
| 23. | 详细信息 |
为了探究铁与氯气的反应,某同学甲设计了如下的实验方案及步骤。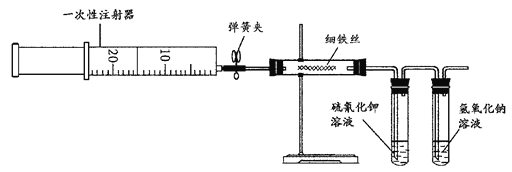 实验装置图 (1)用注射器吸取20 mL左右的________(填化学式)。 (2)按图所示连接实验装置,并固定在铁架台上。经检验装置不漏气。在硬质玻璃管内加入一定量的细铁丝,一支试管内加入硫氰化钾溶液,另一支试管中加入氢氧化钠溶液。 (3)加热硬质玻璃管内铁丝约1 min,然后把注射器中的氯气注入到硬质玻璃管内,观察实验现象。硬质玻璃管内可观察到产生__________色的烟,盛硫氰化钾溶液的试管内显____________。 (4)请写出加入硫氰化钾溶液试管中所发生反应的离子方程式:_____________________。其中,氢氧化钠溶液的作用是______________。 (5)某同学取适量生成物溶于水得50.0mL溶液,加入足量的AgNO3溶液,得21.525g白色沉淀。则溶液中c(Cl-)=__________mol?L-1。 |
|
| 24. | 详细信息 |
|
已知A、B、C、D分别是AlCl3、BaCl2、FeSO4、NaOH四种化合物中的一种,它们的水溶液之间的一些反应现象如下: ①A+B→白色沉淀,加入稀硝酸,沉淀不溶解. ②B+D→白色沉淀,在空气中放置,沉淀由白色转化为红褐色. ③C+D→白色沉淀,继续加D溶液,白色沉淀逐渐消失. (1)则各是什么物质的化学式为:A 、B 、C 、D . (2)现象②中所发生的反应的化学方程式为: 、 . (3)现象③中所发生反应的离子方程式为: 、 . |
|
最近更新




