2018届高三第四次月考化学考试(湖南省祁阳四中)
| 1. | 详细信息 |
|
海水中溶解和悬浮着大量的无机物和有机物,具有巨大的开发潜力,人类除了从海水中获得食盐和水外,还获得大量的钾、镁、溴、碘等,以下说法正确的是(? ) A. 用有机溶剂可萃取海水中的溴、碘 B. 海水中含有碘元素,只需将海水中的碘升华就可以得到碘单质 C. 常用电解氯化钠和氯化镁的水溶液来分别制得钠和镁 D. 从海水中可以得到NaCl,NaCl可作为制造化肥的原料 |
|
| 2. | 详细信息 |
|
设NA为阿伏加德罗常数的数值,则下列说法正确的是( ) A. 0.1mol?L-1的NaHSO4溶液中含有阳离子的物质的量为0.2mol B. 在标准状态下,11.2 L NO与11.2 L O2混合后气体分子数为0.75NA C. 含1molFeCl3的饱和溶液滴入沸水中得到氢氧化铁胶体粒子数目为NA D. 106 g Na2CO3固体中的阴离子数为NA |
|
| 3. | 详细信息 |
|
下列有关物质性质的比较顺序中,不正确的是( ) A. 热稳定性:HF<HCl<HBr<HI B. 微粒半径:K+>Na+>Mg2+>Al3+ C. 酸性:HClO4>H2SO4>H3PO4>H2SiO3 D. 熔点:Li>Na>K>Rb |
|
| 4. | 详细信息 |
|
下列说法正确的是( ) A. 用精密pH试纸测得饱和氯水的pH约为2.2 B. 配制一定物质的量浓度的溶液,定容时仰视刻度,溶液浓度偏小 C. 在中和滴定实验中,锥形瓶需用待测液润洗 D. 制备乙酸乙酯时,将乙醇和乙酸依次加入浓硫酸中 |
|
| 5. | 详细信息 |
|
下列表示对应化学反应的离子方程式正确的是( ) A. 用氯化铁溶液腐蚀铜板:Cu+Fe3+=Cu2++Fe2+ B. Fe3O4与足量稀HNO3反应:3Fe3O4+28H++NO3- C. 用小苏打治疗胃酸过多:NaHCO3+H+=Na++CO2↑+H2O D. 往KAl(SO4)2溶液中滴入Ba(OH)2溶液至沉淀的物质的量最大:Al3+ + 2SO42- + 2Ba2+ + 4OH-== AlO2-+ 2BaSO4↓+ 2H2O |
|
| 6. | 详细信息 |
|
在水中加等物质的量的Ag+、Pb2 +、Na+、 SO42-、 NO3-、 Cl-,该溶液放在用惰性电极做电极的电解槽中,通电片刻,则氧化产物与还原产物质量比为( ) A. 35.5:108 B. 16:207 C. 8:1 D. 108:35.5 |
|
| 7. | 详细信息 |
|
在下列各溶液中通入足量CO2气体,最终有浑浊产生的( ) ①饱和Na2CO3溶液 ②澄清石灰水 ③Ca(ClO)2 溶液 ④CaCl2溶液? ⑤Na2SiO3溶液 ⑥NaAlO2溶液 A. 全部 B. 除①④外 C. 除①②③④外 D. 除②③④外 |
|
| 8. | 详细信息 |
|
下列说法不正确的是(? ) ①将SO2通入溶有足量氨的BaCl2溶液中,无白色沉淀生成 ②将盐酸、KSCN 溶液和Fe(NO3)2溶液三种溶液混合,混合溶液显红色 ③向某溶液中滴入盐酸酸化的BaCl2溶液产生白色沉淀,证明溶液中一定含有SO42- ④将两小块质量相等的金属钠,一块直接投入水中,另一块用铝箔包住,在铝箔上刺些小孔,然后按入水中,两者放出的氢气质量相等 ⑤使用明矾可以对水进行消毒、杀菌 A. 只有② B. ①②③⑤ C. ①③④⑤ D. ①②③④ |
|
| 9. | 详细信息 |
向绝热恒容密闭容器中通入SO2和NO2,一定条件下使反应:SO2(g)+NO2(g)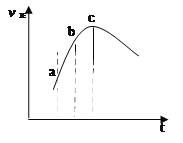 A. 逆反应速率:a点小于点c B. 反应物浓度:a点小于点b C. 反应在c点时处于平衡状态 D. 反应物的总能量低于生成物的总能量 |
|
| 10. | 详细信息 |
液体燃料电池相比于气体燃料电池具有体积小,无需气体存储装置等优点。一种以肼(N2H4)为燃料的电池装置如图所示。该电池用空气中的氧气作为氧化剂,KOH作为电解质。下列关于该燃料电池的叙述不正确的是( )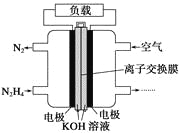 A. 电流从右侧电极经过负载后流向左侧电极 B. 负极发生的电极反应式为N2H4+4OH--4e-===N2↑+4H2O C. 该燃料电池的电极材料应采用多孔导电材料,以提高电极反应物质在电极表面的吸附量,并使它们与电解质溶液充分接触 D. 该燃料电池持续放电时,K+从负极向正极迁移,因而离子交换膜需选用阳离子交换膜 |
|
| 11. | 详细信息 |
|
在含有Ag+的酸性溶液中,以铁铵矾NH4Fe(SO4)2作指示剂,用KSCN的标准溶液滴定Ag+.已知:AgSCN(白色s) A. 边滴定,边摇动溶液,溶液中首先析出AgSCN白色沉淀 B. 当Ag+定量沉淀后,少许过量的SCN-与Fe3+生成红色配合物,即为终点 C. 上述实验可用KCl标准溶液代替KSCN的标准溶液滴定Ag+ D. 滴定时,必须控制溶液一定的酸性,防止Fe3+水解,影响终点的观察 |
|
| 12. | 详细信息 |
|
一定条件下,在体积为10 L的密闭容器中,1 mol X和1 mol Y进行反应:2X(g)+Y(g) A. 以Y浓度变化表示的反应速率为0.0005 mol/(L?s) B. 其他条件不变,将容器体积扩大至20 L,则Z的平衡浓度变为原来的1/2 C. 其他条件不变,将容器体积缩小至5L,平衡正向移动,平衡常数增大 D. 其他条件不变,升高温度逆反应速率加快,正反应速率减慢 |
|
| 13. | 详细信息 |
|
常温下,关于下列各溶液的叙述正确的是( ) A. pH>7的醋酸钠和醋酸的混合溶液中:c(CH3COO-)>c(Na+) B. 0.1mol/L稀醋酸pH=a,0.01mol/L的稀醋酸pH=b,则a+1=b C. 0.1mol/L的醋酸钠溶液20mL与0.1mol/L的盐酸10mL混合后溶液显酸性:c(CH3COOH)-c(CH3COO-)=2[c(OH-)-c(H+)] D. 已知酸性HF>CH3COOH, 浓度相等的NaF溶液与CH3COONa溶液中:NaF溶液的pH比CH3COONa溶液的pH要大。 |
|
| 14. | 详细信息 |
|
常温下,下列各组离子在指定溶液中一定能大量共存的是 A. PH=1的溶液:Na+、Al3+、Cl-、SO42- B. 常温下,c(H+)/c(OH-)=1010的溶液:Fe2+、K+、NO3-、SO42- C. 加入KSCN显红色的溶液:NH4+、K+、Cl-、S2- D. 使甲基橙呈红色的溶液:NH4+、Na+、AlO2-、HCO3- |
|
| 15. | 详细信息 |
|
为监测空气中汞蒸气是否超标,通过悬挂涂有CuI(白色)的滤纸,根据滤纸是否变色(亮黄色至暗红色)及变色所需时间来判断空气中的汞含量。发生的化学反应为:4CuI+Hg=Cu2HgI4+2Cu。下列说法不正确的是 A. 上述反应属于置换反应 B. 当有1 mol CuI反应时,转移电子为0.5 mol C. 该反应中的氧化剂为CuI D. Cu2HgI4既是氧化产物又是还原产物 |
|
| 16. | 详细信息 | ||||||||||
高氯酸、硫酸、硝酸和盐酸都是强酸,其酸性在水溶液中差别不大,以下是某温度下这四种酸在冰醋酸中的电离常数
|
|||||||||||
| 17. | 详细信息 |
|
金属元素及其化合物在科学研究和生产生活中有着广泛的用途 (1)氢气还原氧化铜时,产生的红色物质,冷却后加入稀硫酸发现溶液呈淡蓝色,写出该现象发生的离子方程式__________________________。 (2)取铝合金(含铝90%)1.5 g 与适量的 盐酸恰好完全反应(合金中其它成分不参加反应)。滤去不溶物,向滤液加入0.6 mol?L-1 的氨水使Al3+ 恰好完全沉淀。上述铝合金和盐酸反应的过程中生成氢气_____L(标准状况)。使Al3+ 恰好完全沉淀时,消耗氨水____mL。 |
|
| 18. | 详细信息 |
|
有X、Y、Z、W四种短周期元素,原子序数依次增大。X的阳离子就是一个质子。Z、W在周期表中处于相邻位置,它们的单质在通常状况下均为无色气体。Y原子的最外层电子数是次外层电子数的2倍。请回答: (1)Z2的电子式为_________,Y的原子结构示意图为________,YW2的结构式为________。 (2)将X2、W2 按下图所示通入某燃料电池中,其中,b电极的电极反应式为________。若有16gW2参加反应,转移的电子数是_______NA。  (3)由X、Y、Z、W四种元素组成的无机酸酸式盐,与足量的NaOH溶液在加热条件下反应的离子方程式为______________________________________________ |
|
| 19. | 详细信息 | ||||||||||||||
|
(Ⅰ)工业上通常采用CO(g)和H2(g)催化合成甲醇CH3OH(g)。 (1)已知在某温度和压强下: ①2CO(g)+O2(g)=2CO2(g) △H= -566.0 kJ?mol-1 ②2H2(g)+O2(g)=2H2O(g) △H= - 483.6 kJ?mol-1 ③2CH3 OH(g)+3O2(g)=2CO2(g)+4H2 O(g)? △H= -1275.6 kJ?mol-1 则在相同的温度和压强下,CO(g)与H2(g)合成CH3OH(g)的热化学方程式是_________________________________________________________。 (2)某化学研究性学习小组模拟工业合成甲醇的反应,在容积固定为2L的密闭容器内充入1 molCO和 2 molH2,加入合适催化剂(体积可以忽略不计)后在250°C开始反应,甲醇的物质的量的变化如下:
|
|||||||||||||||
| 20. | 详细信息 |
已知草酸是酸性强于醋酸的二元弱酸,对应的钙盐(CaC2O4)不溶于醋酸,能溶于强酸,它还是一种还原性较强的物质。下图是利用饱和草酸溶液与KClO3粉末在60℃时反应制得ClO2,ClO2是一种黄绿色有刺激性气味的气体,熔点-59℃,沸点11- 0℃。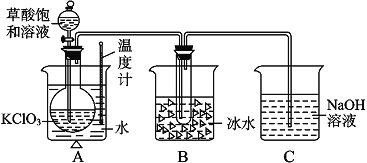 (1)配平该反应化学方程式:____KClO3+ H2C2O4== KHCO3+ ClO2↑ (2)B装置的作用是______________________ 。 (3)C装置是尾气处理装置,反应一段时间后,C中含有NaOH、NaClO2、NaClO3等溶质,有同学说,C中还可能含有Na2CO3,试分析可能的原因:_____________。 |
|
| 21. | 详细信息 |
用软锰矿(主要成分为MnO2,还有少量含铁、铜、汞的化合物)制备MnSO4电解液继而提取锰的工业流程如下 (1)已知锰粉的主要成分为MnO,反应①的化学方程式为________________________。 (2)实验室可用软锰矿与浓盐酸反应制Cl2,比较MnO2、C12、Fe3+的氧化性强弱:_______。 (3)溶液I中加入一定质量的MnO2以测定Fe2+的浓度,加入MnO2有关反应的离子方程式为___________________________________________________________________。 (4)已知90℃时水的离子积常数Kw=3.6×10-13,Fe(OH)3的Ksp=6.4×10-25,要使滤渣A沉淀完全,需用氨水调pH至少为______(已知lg 3≈0.5)。 (5)溶液Ⅰ的主要成分为? ____________。滤渣B的主要成分为_________________。 (6)工业上用二氧化锰制备高锰酸钾,先用二氧化锰制得锰酸钾,再用惰性电极电解锰酸钾溶液得到高锰酸钾,电解时阳极反应式为____________________。 |
|
最近更新




