重点高中协作体高一化学期中考试(2018年上册)试卷带答案和解析
| 1. 选择题 | 详细信息 |
|
清初《泉州府志》记载:“初,人不知盖泥法,元时南安有黄长者为宅煮糖,宅垣忽坏,去土而糖白,后人遂效之。” 下列选项中,与文中“盖泥法”的原理相同的是 A. 从地沟油中蒸馏出植物油 B. 活性炭除去水中的红色墨汁 C. 用结晶法除去KNO3中的NaCl D. 用过滤法除去河水中泥沙 |
|
| 2. 选择题 | 详细信息 |
|
下列实验操作中,完全正确的一组是 ①用试管夹夹持试管时,试管夹从试管底部往上套,夹在试管的中上部 ②稀释浓硫酸时将水倒入浓硫酸中进行搅拌 ③把鼻孔靠近容器口去闻气体的气味 ④将试管平放,用纸槽往试管里送入固体粉末,然后竖立试管 ⑤倾倒细口瓶里的液体时,瓶上的标签对着地面 ⑥将烧瓶放在桌上,再用力塞紧塞子 ⑦用坩埚钳夹取加热后的蒸发皿 ⑧将滴管垂直伸进试管内滴加液体 A. ④⑤⑥⑧ B. ①②⑤⑦ C. ①③⑤⑦⑧ D. ①④⑦ |
|
| 3. 选择题 | 详细信息 |
|
下列关于纯净物、混合物、电解质、非电解质的正确组合为 A. 纯盐酸、水煤气、硫酸、干冰 B. 冰水、蔗糖溶液、氧化铝、二氧化硫 C. 胆矾、氢硫酸、铁、碳酸钙 D. 重钙、普钙、氯化铜、碳酸钠 |
|
| 4. 选择题 | 详细信息 |
|
CO2、H2和CO组成的混合气体在同温同压下与氮气的密度相同。则该混合气体中CO2、H2和CO的体积比为 A. 29∶8∶13 B. 22∶1∶14 C. 13∶8∶29 D. 13∶16∶57 |
|
| 5. 选择题 | 详细信息 |
|
把各组中的气体通入溶液中,溶液导电能力显著增强的是 A. CO2(g)通入NaOH溶液中 B. CO2(g)通入石灰水中 C. NH3(g)通入CH3COOH溶液中 D. NH3(g)通入盐酸中 |
|
| 6. 选择题 | 详细信息 | ||||||||||||||||||||
除去某物质中所含的杂质,所选用的试剂或操作方法不正确的是
|
|||||||||||||||||||||
| 7. 选择题 | 详细信息 |
|
NA是阿伏加德罗常数的值,下列说法正确的是 A. 常温常压下,11.2 LHCl气体中含有的分子数为0.5NA B. 常温常压下,5.6 g N2和CO混合物中所含有的原子数为0.4NA C. 将0.2 mol FeCl3制成胶体,所得胶体粒子数为0.2NA D. 50 mL12 mol/L盐酸与足量Fe反应,转移电子数为0.3NA |
|
| 8. 选择题 | 详细信息 |
|
下列溶液中c(Cl-)与50mL 1 mol/L AlCl3溶液中的c(Cl-)相等的是 A. 150mL l mol/L NaCl溶液 B. 150 mL3mol/L KCl溶液 C. 75mL2 mol/L CaCl2溶液 D. 75 mL l mol/L FeCl2溶液 |
|
| 9. 选择题 | 详细信息 |
|
在一个大试管里注入0.0l mol/L碘化钾溶液l0 mL,用胶头滴管滴入8~10滴相同浓度的硝酸银溶液,边滴加边振荡,即得碘化银胶体。下列说法正确的是 A. 布朗运动是该胶体稳定的主要原因 B. 提纯上述碘化银胶体,需要的实验用品有漏斗、滤纸、烧杯、玻璃棒等 C. 用上述胶体做电泳实验,发现阳极附近颜色逐渐变深,说明该胶体粒子带负电荷 D. 在上述碘化银胶体中快速滴加0.0l mol/L硝酸银溶液至l0mL,将得到更多的胶体 |
|
| 10. 选择题 | 详细信息 |
|
在某澄清透明的溶液中,下列各组离子中能大量共存的是 A. I-、NO3-、Fe2+、Na+ B. Ag+、NO3-、Cl-、K+ C. K+、Ba2+、OH-、SO42- D. Cu2+、NH4+、Br-、OH- |
|
| 11. 选择题 | 详细信息 |
|
K2FeO4可用作水处理剂,它可由3Cl2 +2Fe(OH)3 +10KOH ===2K2FeO4 +6KCl +8H2O制得。下列说法不正确的是 A. 氧化性:Fe(OH)3 >K2FeO4 B. Cl2是氧化剂,Fe(OH)3在反应中失去电子 C. 上述反应的氧化剂与还原剂物质的量之比为3:2 D. 每生成l mol氧化产物转移的电子的物质的量为3 mol |
|
| 12. 选择题 | 详细信息 |
|
下列反应的离子方程式书写不正确的是 A. 稀硫酸滴在铁片上:Fe+2H+ ===2Fe2+ +H2↑ B. 铜片插入硝酸银溶液中: Cu+2Ag+ ===Cu2+ +2Ag C. 碳酸氢钙溶液跟足量烧碱溶液反应:Ca2++HCO3-+OH-===CaCO3↓+H2O D. 醋酸滴在石灰石上:CaCO3 + 2CH3COOH=== Ca2++2CH3COO-+CO2↑+H2O |
|
| 13. 选择题 | 详细信息 |
|
下列说法正确的是 A. 把100 mL3mol/LH2SO4跟100 mL H2O混合后,溶液中c(H+)为1.5 mol/L B. 把100 mL 20% NaOH溶液跟100 mL H2O混合后,NaOH溶液的质量分数是10% C. 把200 mL3 mol/LBaCl2溶液跟100 mL3mol/LKCl溶液混合后,溶液中c(Cl-)仍然是3mol/L D. 把100 g 20% NaCl溶液跟100 g H2O混合后,NaCl溶液的质量分数是10% |
|
| 14. 选择题 | 详细信息 |
|
在两个密闭容器甲、乙中,依次充入氧原子数目相同的O2、O3两种气体,若它们的温度和密度均相同。下列说法正确的是 A. 气体体积:甲>乙 B. 气体的压强:甲>乙 C. 气体的分子数:甲<乙 D. 气体的质量:甲<乙 |
|
| 15. 选择题 | 详细信息 | ||||||||||||||||||
向60mL Na2SO4溶液中加入BaCl2溶液,有关数据见下表,下列有关说法正确的是
|
|||||||||||||||||||
| 16. 填空题 | 详细信息 |
|
已知十种物质:①H2O ②空气 ③ Mg ④ CaO ⑤H2SO4 ⑥氢氧化钡 ⑦饱和FeCl3溶液 ⑧氨水 ⑨HNO3 ⑩胆矾,根据上述提供的物质,回答下列问题: (1)属于混合物的是___________(填序号,下同),属于弱电解质的是_______________。 (2)上述物质中_____与_____在水溶液中可发生反应,且离子方程式为H++OH-===H2O。 (3)实验室制备少量Fe(OH)3胶体所用的物质有____________,反应的离子方程式为_____________________________________________。 (4)实验室配制900mL 0.1mol/L硫酸铜溶液,需要称取的溶质(从上述物质中选取)的质量为________g,从配制好的溶液中取出300mL,其中含有SO42-的数目为_______(设NA为阿伏加德罗常数的值)。 |
|
| 17. 计算题 | 详细信息 |
|
按要求回答下列问题: (1)当H2O和H2O2分子个数比为1:1 时,原子总数之比为_____________,电子数之比为________________。 (2)V mLAl2(SO4)3溶液中含a gAl3+,取出V/4 mL溶液稀释成V mL后,SO42-的物质的量浓度为______________(用含a、V的代数式表示,化简到最简整数比)。 (3)在一定条件下,11.2 g单质R与0.3 molCl2完全反应,生成0.2 molRClx,则x=______,RClx 的摩尔质量为_______________。 |
|
| 18. 综合题 | 详细信息 |
|
实验室要配制80 mlL1.00 mol/LNaCl溶液,实验室现有含有少量碳酸钠的氯化钠固体。 Ⅰ.为了除去氯化钠样品中的杂质,某兴趣小组最初设计了如下方案进行实验:  (1)沉淀A的化学式是_______________。 (2)在实验过程中,又发现了新的问题:此方案很容易引入新的杂质。则固体物质B的成分为_________________(用化学式表示)。 (3)继续探究后又提出了新的方案:将混合物溶解,先滴加足量_________________(填试剂名称),再蒸发结晶,有关反应的离子方程式为_______________________________。 Ⅱ.配制溶液: (1)配制过程中需要使用的玻璃仪器除烧杯和玻璃棒外还有_________________。 (2)从所配溶液中取出10mL,与足量AgNO3溶液反应,经过滤、洗涤、干燥后得到白色沉淀1.50 g。则所配溶液的浓度________1.00 mol/L (填“>”、“<”或“=”),造成此误差的操作可能是_______________。 A.使用容量瓶前未干燥 B.用托盘天平称量氯化钠固体时将砝码错放在左盘 C.定容时俯视容量瓶的刻度线 D.定容后经震荡、摇匀、静置,发现液面下降,再加适量的蒸馏水 |
|
| 19. 综合题 | 详细信息 |
|
Ⅰ.已知某反应中反应物和生成物有:KMnO4、H2SO4、MnSO4、H2C2O4、K2SO4、H2O和一种未知物X。 (1)已知0.5 molH2C2O4在反应中失去1 mol电子生成X,则X的化学式为______________。 (2)将氧化剂和还原剂及配平的系数填入下列方框中,并用单线桥标出电子转移的方向和数目。 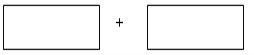 ___________________________ Ⅱ.工业废水中含有大量的FeSO4、较多的Cu2+和少量的Na+。从工业废水中回收硫酸亚铁和金属铜的工艺流程如图所示。  (1)图中操作①为______________;操作③为_______________________________。 (2)试剂X为______(填化学式),操作②涉及的离子反应方程式为___________________。 |
|
| 20. 推断题 | 详细信息 |
|
有一包固体混合物粉末,其中可能含有Na2SO4、K2CO3、CuSO4、BaCl2、NaCl, 现按如下操作步骤进行实验: ①取部分固体混合物溶于水中,振荡,得无色透明溶液; ②取①所得溶液,滴加过量硝酸钡溶液,有白色沉淀产生; ③过滤,将沉淀物置于稀硝酸中,发现沉淀部分溶解。 根据上述实验事实,回答下列问题: (1)原固体混合物粉末中一定含有的物质是_____________________,一定不含有的物质是_______________,可能含有的物质是____________________ (以上空格均填写化学式)。 (2)写出步骤③中的离子方程式_______________________________________。 (3)若要检验K2CO3中Cl-和SO42-是否除尽,选用的试剂及加入的先后次序是_______ (填字母)。 a.HCl、BaCl2、AgNO3 b.HNO3、Ba(NO3)2、AgNO3 c.AgNO3、HNO3、Ba(NO3)2 d.AgNO3、HCl、BaCl2 |
|
最近更新



