山东省济南市2020-2021年高二1月学情诊断化学在线测验完整版
| 1. 选择题 | 详细信息 |
|
下列说法正确的是( ) A.利用太阳能、风能和氢能替代化石燃料能有效改善空气质量 B.加热蒸干Na2CO3溶液,可得到NaOH固体 C.铅蓄电池属于一次电池 D.保护水中的钢闸门,应将其与电源正极连接 |
|
| 2. 选择题 | 详细信息 |
由反应物X转化为Y或Z的能量变化如图所示。下列说法正确的是( ) A.反应2X(g) B.反应2X(g) C.增大压强有利于提高Y的产率 D.若发生反应Z(g) |
|
| 3. 选择题 | 详细信息 |
|
T℃恒容条件下,通过下列反应可实现燃煤烟气中硫的回收:SO2(g)+2CO(g) A.随着反应的进行,容器内压强始终不变 B.其他条件不变,若在T℃恒压条件下进行该反应,平衡时SO2的转化率会降低 C.其他条件不变,升高温度可提高S的回收率 D.其他条件不变,使用更高效催化剂,该反应的平衡常数不变 |
|
| 4. 选择题 | 详细信息 |
|
常温下,下列各组离子一定能大量共存的是( ) A.甲基橙呈黄色的溶液中:I-、Cl-、NO B.由水电离出的c(H+)=1×10-14 mol·L-1的溶液中:Ca2+、K+、Cl-、HCO C. D.c(Fe3+)=0.5 mol·L-1的溶液中:K+、HCO |
|
| 5. 选择题 | 详细信息 |
|
下列关于原子结构与元素周期表的说法正确的是( ) A.电负性最大的元素位于周期表的左下角 B.某基态原子的价电子排布式为4s24p1,该元素位于周期表第四周期IIIA族 C.2s轨道在空间呈双球形分布 D.基态原子3p能级电子半充满的原子第-电离能小于3p能级有两个未成对电子的原子 |
|
| 6. 选择题 | 详细信息 |
热激活电池可用作火箭、导弹的工作电源。一种热激活电池的基本结构如图所示,其中作为电解质的无水LiCl-KCl混合物一旦受热熔融,电池瞬间即可输出电能。该电池总反应为PbSO4+2LiCl+Ca=CaCl2+Li2SO4+Pb。下列说法正确的是( ) A.正极的电极反应为Ca+2Cl--2e-=CaCl2 B.放电过程中,Li+向钙电极移动 C.LiCl既是离子导体又是正极反应物 D.常温时,在正负极之间连上检流计,指针不偏转 |
|
| 7. 选择题 | 详细信息 |
|
下列各组中,两种基态原子一定位于同一主族的是( ) A.核外L层仅有2个电子的原子与核外M层仅有2个电子的原子 B.核外电子排布为1s2的原子与核外电子排布为1s22s2的原子 C.2p轨道只有1个未成对电子的原子与3p轨道只有1个未成对电子的原子 D.最外层均只有1个电子的两种原子 |
|
| 8. 选择题 | 详细信息 |
研究表明N2O与CO在Fe+作用下发生反应的能量变化及反应历程如图所示,下列说法错误的是 A. 总反应是放热反应 B. Fe+使反应的活化能降低 C. FeO+也是该反应的催化剂 D. Fe++N2O→FeO++N2、FeO++CO→Fe++CO2两步反应均为放热反应 |
|
| 9. 选择题 | 详细信息 | |||||||||||||||
下列操作能达到实验目的的是( )
|
||||||||||||||||
| 10. 选择题 | 详细信息 |
关于图中电化学装置,有关叙述正确的是( ) A.装置①的石墨电极上会析出金属钠 B.装置②中随着电解的进行左边电极会产生红色的铜 C.装置③中的离子交换膜为阴离子交换膜 D.装置④的待镀铁制品应与电源正极相连 |
|
| 11. 选择题 | 详细信息 |
|
下列说法错误的是( ) A.两个原子之间最多能形成1个σ键 B.HF、HCl、HBr、HI的沸点逐渐升高 C.H2O2是-种含极性键和非极性键的极性分子 D.气体单质分子中一定有σ键,可能有π键 |
|
| 12. 选择题 | 详细信息 | ||||||||||
在一定温度下,将气体X和气体Y各0.16 mol充入10 L恒容密闭容器中,发生反应X(g)+Y(g)
下列说法正确的是( ) |
|||||||||||
| 13. 选择题 | 详细信息 |
粉煤灰的主要成分为SiO2、Al2O3、FeO、Fe2O3、MgO、TiO2等,研究小组对其进行综合处理的流程如图: 已知: ①“酸浸”后钛主要以TiOSO4形式存在,在溶液中完全电离出SO ②当离子浓度小于等于1.0×10-5 mol·L-1时,可认为其已沉淀完全。 ③Ksp[Al(OH)3]=1.0×10-34、Ksp[Fe(OH)3]=4.0×10-38。 下列说法错误的是( ) A.“酸浸”时TiO2发生反应的离子方程式为TiO2+2H+=TiO2++H2O B.“结晶”时应控制适宜温度,温度过高TiO2·xH2O产率降低 C.“调pH”时温度越高,氧化速率越快 D.为使“滤液2”中杂质离子沉淀完全,pH的理论最小值为4.3 |
|
| 14. 选择题 | 详细信息 |
一种可在一分钟内完成充放电的超常性能铝离子电池,离子导体为AlCl A.放电时,铝为负极、石墨为正极 B.放电时,电子由石墨经电解质溶液流向铝 C.放电时的负极反应为Al+7AlCl D.充电时的阳极反应为Cn+AlCl |
|
| 15. 选择题 | 详细信息 |
25℃时,有c(CH3COOH)+c(CH3COO-)=0.1 mol·L-1的醋酸和醋酸钠混合溶液,其中c(CH3COOH)、c(CH3COO-)与溶液pH的关系如图所示。下列说法正确的是( ) A.该体系中c(CH3COO-)= B.pH=3.5时,溶液中存在:c(Na+)+c(H+)-c(OH-)+c(CH3COOH)=0.1 mol·L-1 C.pH=5.5时,溶液中存在:c(CH3COOH)>c(CH3COO-)>c(H+)>c(OH-) D.向W点溶液中通入0.05 mol HCl气体后存在:c(H+)=c(CH3COOH)+c(OH-) |
|
| 16. | 详细信息 |
|
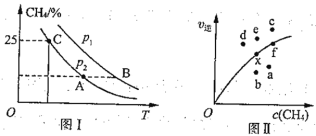
研究大气中含硫化合物(主要是SO2和H2S)的转化具有重要意义。回答下列问题: (1)高温条件下,利用催化剂可将大气样品中的含硫化合物(SO2和H2S的含量分别为0.16 mg·m-3和0.34mg·m-3)完全转化为单质硫,该过程为_______(用一个化学方程式表示)。 (2)土壤中的微生物可将大气中的H2S经两步反应氧化成SO  1 mol SO (3)二氧化硫-空气质子交换膜燃料电池可以利用大气所含SO2快速启动,原理如图所示:  ①放电时消耗SO2和O2的物质的量之比为_______。 ②负极的电极反应式为_______。 (4)燃煤烟气的脱硫减排是减少大气中含硫化合物的关键,用纯碱溶液吸收SO2生成CO2和HSO |
|
| 17. 填空题 | 详细信息 |
|
雌黄(As2S3)和雄黄(As4S4)都是自然界中常见的含砷化合物,早期都曾用作绘画颜料,也可入药。回答下列问题: (1)砷元素有+2、+3两种常见价态。一定条件下,雌黄和雄黄的转化关系如图所示。物质a为_______(填化学式);可用双氧水将As2O3(砒霜)转化为无毒的H3AsO4,写出该反应的化学方程式:_______。  (2)亚砷酸(H3AsO3)可以用于治疗白血病,其在溶液中存在多种形态,25℃时,各种形态的物质的量分数与溶液pH的关系如图所示:  ①人体血液的pH在7.35~7.45之间,用药后血液中砷元素的主要形态是_______。 ②下列说法正确的是_______(填标号)。 A.n(H3AsO3):n(H2AsO B.随着pH增大, C.pH=12时,溶液中c(H2AsO D.pH=14时,c(AsO ③将KOH溶液滴入亚砷酸溶液至pH为11时,反应的离子方程式为_______。 (3)P和As属于同主族元素,工业制备亚磷酸的装置如图所示: 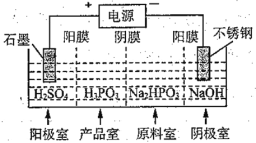 ①产品室中反应的离子方程式为_______; ②得到1 mol亚磷酸的同时,阴极室能制得_______g NaOH。 |
|
| 18. | 详细信息 |
|
铁及其氧化物是日常生活中广泛应用的材料。回答下列问题: (1)基态铁原子的价电子轨道表示式为_______。 (2)铁元素常见的离子有Fe2+和Fe3+,稳定性Fe2+_______Fe3+(填“大于”或“小于”),原因是_______。 (3)纳米氧化铁能催化火箭推进剂NH4ClO4的分解,NH |
|
| 19. | 详细信息 |
|
甲、乙、丙、丁、戊、己均为前四周期元素。已知甲、乙、丙、丁、戊5种非金属元素原子半径依次减小,其中基态甲原子的s电子总数是p电子总数的2倍;已是第四周期元素,最外层只有1个电子,其余各层电子均充满。回答下列问题: (1)甲、乙、丙、丁4种元素电负性由大到小的顺序为_______(用元素符号表示)。 (2)甲、乙、丙均能与戊组成ABn型化合物,其中甲形成的化合物沸点最低,原因是_______;键角最小的是_______(填化学式),原因是_______。 (3)己位于元素周期表中的_______区,其单质中存在的微粒间作用为_______。 |
|
| 20. | 详细信息 | ||||||||||||||||||||||||||
|
CO2和CH4是两种主要的温室气体,以CO2和CH4为原料制造更高价值的化学产品是用来缓解温室效应的研究方向。回答下列问题: (1)工业上CO2-CH4催化重整是目前大规模制取合成气(CO和H2混合气)的重要方法,其原理为: 反应I:CH4(g)+H2O(g) 反应II:CO(g)+H2O(g) 几种化学键的键能如表所示:
①a=_______kJ·mol-1。
①若用单位时间内气体分压(气体分压=气体总压×体积分数)的变化来表示反应速率,则反应I前120min内的平均反应速率v(CH4)=_______kPa·min-1(结果保留2位小数)。 |
|||||||||||||||||||||||||||