信阳市九年级化学2019年下学期月考测验在线答题
| 1. 选择题 | 详细信息 |
|
蒙华铁路是全国最长的运煤专线,途经内蒙古、陕西、山西、河南、湖北、湖南、江西七个省,预计将在2019年全线通车。蒙华铁路施工现场有下列现象,其中包含化学变化的是( ) A. 起吊工件 B. 焊接钢轨 C. 锯断木材 D. 粉碎石子 |
|
| 2. 选择题 | 详细信息 |
|
美国航天局卫星数据表明,地球比20年前更绿了,而全球新增的绿化面积中,约1/4来自中国,贡献比例居全球首位。为了让地球更绿,下列行为不正确的是( ) A. 治理雾霾,积极开发利用太阳能、风能等清洁能源 B. 绿色出行,提倡自行车作交通工具 C. 推广使用一次性木筷,减少疾病传染 D. 采用“绿色化学”工艺,使原料尽可能转化为所需产品 |
|
| 3. 选择题 | 详细信息 |
|
分类是研究物质的常用方法。下列分类正确的是( ) A. 氧化物:FeO、COCl2 、SiO2 B. 人体必需微量元素:K、Fe、F C. 合成材料:塑料、合成纤维、橡胶 D. 由分子构成的物质:CH4、C60、HCl |
|
| 4. 选择题 | 详细信息 |
如图是元素周期表中的一部分,下列有关说法中正确的是( )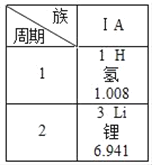 A. 锂原子的质子数为3 B. 氢元素的相对原子质量1.008g C. 锂元素和氢元素都属于金属元素 D. 锂元素和氢元素属于同周期元素 |
|
| 5. 选择题 | 详细信息 |
|
某同学欲检测从小商店买回的食盐是否是加碘食盐[加碘食盐中的碘元素以碘酸钾(KIO3)形式存在]。他查阅资料得知加碘食盐中的KIO3在酸性条件下能与KI溶液发生反应生成碘(I2),I2遇淀粉变蓝色。现提供下列试剂和生活中常见的物质:①米汤②纯碱③KI溶液④白糖⑤白酒⑥白醋。该同学进行检测必须选用的试剂和物质是( ) A. ①③④ B. ①③⑥ C. ②④⑥ D. ①④⑤ |
|
| 6. 选择题 | 详细信息 | ||||||||
化学学科核心素养是学生通过化学课程学习形成的关键能力和必备品格。下列说法不正确的是( )
|
|||||||||
| 7. 选择题 | 详细信息 |
|
下列实验设计或实验操作能达到预期目的的是( ) A.  比较可燃物的着火点 比较可燃物的着火点B.  探究温度对反应速率的影响 探究温度对反应速率的影响C.  称量固体药品 称量固体药品D.  探究影响溶解性的因素 探究影响溶解性的因素 |
|
| 8. 选择题 | 详细信息 |
|
Mg2Cu是一种新型贮氢材料,是由一定质量比的Mg、Cu单质高温时在氩气保护下熔炼获得的。该物质完全吸氢过程中的反应方程式为2Mg2Cu+3H2 A. X的化学式为MgCu B. 该反应属于置换反应 C. MgH2中氢元素的化合价为+1 D. 通入氩气的目的是作保护气,防止Mg、Cu与氧气发生反应 |
|
| 9. 选择题 | 详细信息 |
某溶液含有Cu(NO3)2和AgNO3,先向其中加入一定量的铁粉进行处理,并绘制参加反应的铁与溶液中溶质种类的关系图(如下图)。下列说法正确的是( )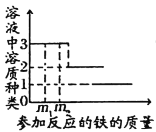 A. 当参加反应的铁的质量为m1时,溶质的种类、金属单质种类均为3种 B. 当参加反应的铁的质量为m1、m2时,两者溶液中Cu(NO3)2的质量分数相等 C. 溶质种类为2种时,金属单质种类可能为2种 D. 当溶质种类为1种时,金属单质种类可能为1种 |
|
| 10. 选择题 | 详细信息 |
|
区分下列物质所选用的试剂或方法不能达到目的的是( ) A. 稀盐酸和稀硫酸(石蕊溶液) B. 磷矿粉和硝酸铵(看外观) C. 氯化钠固体和氢氧化镁固体(水) D. 腈纶和棉花(灼烧,闻气味) |
|
| 11. 选择题 | 详细信息 |
|
下列曲线的变化趋势能正确反映对应操作的是( ) A.  浓硫酸敞口放置一段时间 B. 浓硫酸敞口放置一段时间 B.  用氯酸钾制氧气 用氯酸钾制氧气C. 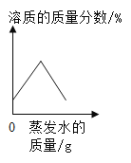 60℃时恒温蒸发饱和的KNO3溶液 D. 60℃时恒温蒸发饱和的KNO3溶液 D.  将一定量的氢氧化钠固体加入水中 将一定量的氢氧化钠固体加入水中 |
|
| 12. 选择题 | 详细信息 |
|
常温下乙烷(C2H6)气体和酒精蒸气的混合物中,氧元素的质量分数为x%,则其混合物中碳元素的质量分数是( ) A. |
|
| 13. 选择题 | 详细信息 |
|
现有200g含氢氧化钡和氢氧化钠的溶液,已知该溶液中Ba2+和Na+的个数比为1:2,向该溶液中通入CO2,至恰好完全反应(不考虑生成碳酸氢盐),过滤,得滤液189.1g,则原溶液中氢氧化钠的质量分数为 A. 16% B. 10% C. 8% D. 4% |
|
| 14. 填空题 | 详细信息 |
|
现代人对生活品质的要求越来越高,对食品追求色、香、味俱全,食品添加剂应运而生。 (1)为防止食品腐败变质常向食品中添加防腐剂,如苯甲酸(C6H5COOH)。苯甲酸中碳、氢元素的质量比为____。 (2)为改善食品口感,厨房常备食盐、小苏打、蔗糖、食醋等,其中常用作膨松剂的是____(填化学式)。 |
|
| 15. 简答题 | 详细信息 |
|
经过一年化学知识的学习,我们可以初步认识到:化学反应的快慢、现象、生成物等与反应物的量有着密切关系。请各举一例说明 (1)反应物的量不同,生成物可能不同:______。 (2)反应物的量不同,反应现象可能不同:____。 (3)反应温度不同,反应速率可能不同:___。 |
|
| 16. 简答题 | 详细信息 |
下图是A、B两种物质的溶解度曲线,请回答: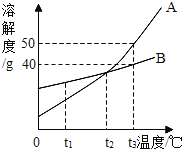 (1)在其他条件不变的情况下,若把t2℃时A、B的饱和溶液分别降温至t1℃,此时两种溶液中溶质的质量分数的大小关系为A____(填“>”“<”或“=”)B。 (2)若B物质中混有少量A物质,要提纯B物质,可采用的方法是_____。 (3)t3℃时,把70gB的饱和溶液稀释为10%,需要加水___g。 |
|
| 17. 填空题 | 详细信息 |
| “有约不来过夜半,闲敲棋子落灯花。”诗中“灯花”是蜡烛_______(填“爆炸”“完全燃烧”或“不完全燃烧”)产生的炭附着在烛芯上的现象;家用液化石油气与石蜡属于同类别物质,欲使其燃烧不产生“灯花”现象的方法是______;若厨房着火,应立即移走液化石油气罐,这样做的理由是____。 | |
| 18. 推断题 | 详细信息 |
在如图所示的转盘中,A~F分别代表Na2CO3、NaNO3、NaOH、HNO3、Na2SO4、NaCl六种物质中的一种。B的俗名为纯碱,E的物质类别为酸,A、B、C、D、E都能转化成F,A、B、C、D能依次转化。请根据初中所学化学知识回答下列问题: (1)F的化学式为____。 (2)让指针顺时针从当前位置开始转动,若所指物质不能转化为下一种物质,指针可继续转动,否则停止。则指针将停止在_____ (填字母编号)物质上。 (3)写出C转化成D的化学方程式: ______。 |
|
| 19. 计算题 | 详细信息 |
|
叠氮化钠(NaN3)被广泛应用于汽车安全气囊,紧急刹车时,安全气囊立即自动充气,其产生气体的原理是叠氮化钠与氧化铜反应生成氧化钠、铜和氮气,该反应的化学方程式为______。已知Cu+Cl2 |
|
| 20. 简答题 | 详细信息 |
化学兴趣小组同学用红磷燃烧的方法对空气中氧气的含量进行测定,实验过程中红磷足量、装置气密性良好、操作规范,实验结束后测定结果却低于20%,用测定氧气浓度的传感器测得反应后装置内氧气浓度为8.85%。小组同学查阅资料后改用足量白磷进行实验,测得反应后装置内氧气浓度为3.21%。请回答下列问题: (1)白磷燃烧的微观示意图如图,写出白磷燃烧的化学方程式_____。 (2)采用教材装置测定空气中氧气含量时,改用白磷能使测定结果更准确的原因是_____。 |
|
| 21. 实验探究题 | 详细信息 |
(1)如图是某微型实验的装置图,试管中的反应发生后,a、b两处及烧杯中的现象是________。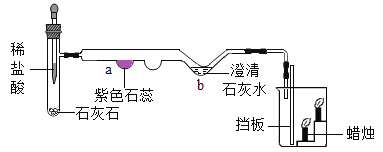 (2)采用微型实验装置的优点是____________(答出一条即可)。 |
|
| 22. 实验探究题 | 详细信息 |
根据下列实验装置图,回答有关问题: (1)实验室常用锌粒和稀硫酸反应制取氢气,若要控制产生氢气的速率,应选择的发生装置和收集装置是_____(从A~F中选择)。 (2)实验室现用G装置制取二氧化碳气体。 ①将装有石灰石的干燥管放入装有稀盐酸的烧杯内,同时打开弹簧夹,写出干燥管内发生反应的化学方程式:_____。 ②一段时间后,关闭弹簧夹,反应停止,其原理是_____。 |
|
| 23. 简答题 | 详细信息 |
九年级某班的化学兴趣小组同学对“氢氧化钠与稀盐酸的中和反应”进行了实验探究。小组同学采用的是测量溶液温度变化的方法。向一定体积10%的氢氧化钠溶液中滴加10%的稀盐酸,并对反应过程中溶液的温度与加入稀盐酸体积的变化进行记录,结果如图所示: (1)据图判断a点时溶液显___性。 (2)拓展探究:该小组同学的实验中除了温度变化,没有其他明显现象,用什么方法可以证明溶液温度达到最高时,此反应恰好完全反应呢?请你帮助该小组同学设计一个实验方案。(1.写出实验操作、预期现象及结论;2.采用除了测pH值以外的方法)_______ |
|
| 24. 综合题 | 详细信息 | ||||||||||
|
碳酸钠在实际生产、生活中有着广泛的用途,如制造玻璃、造纸和纺织等。 (1)碳酸钠俗称苏打或____。如图为侯氏制碱法的流程图,通过步骤I后得到的悬浊液中有小苏打(在该溶液中难溶)和一种氮肥,请写出步骤I中发生反应的化学方程式:_____;上述过程中得到的氮肥遇碱会生成具有刺激性气味的______(填化学式),该气体能使_____;从流程图中可得出小苏打的一条化学性质是_____。 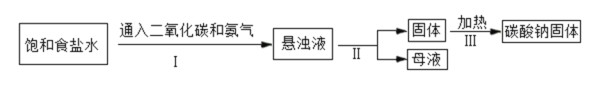 (2)氢氧化钠在空气中容易变质生成碳酸钠,现有放在空气中一段时间的氢氧化钠溶液,其中溶质的成分可能是:猜想①:NaOH;猜想②:Na2CO3;猜想③:_____。请设计实验证明猜想③正确。(写出相关的步骤和现象)________ (3)某海洋化工集团生产的碳酸钠产品中含有少量氯化钠杂质,其产品包装袋上标明:碳酸钠≥96%。为测定该产品中碳酸钠的质量分数,现取11.0g碳酸钠样品放入烧杯中,称得烧杯及所盛碳酸钠样品的总质量为158.0g,然后向烧杯中加入100g稀盐酸,充分反应,实验数据记录如下:
|
|||||||||||
初中化学 试卷推荐
最近更新



